
МОР лекция 1
.pdf
Понятие механизма реакции
Ø Совокупность и последовательность элементарных стадий составляют механизм реакции
Для установления механизма |
Последовательность элементарных |
|
стадий |
||
реакции необходимо, как |
|
|
минимум, определить: |
|
|
Строение промежуточных |
||
|
||
|
продуктов или тип интермедиатов |
|
|
|
Лимитирующую стадию
Исходные
вещества
Продукты
реакции

Энергетика органических реакций

Энергетика органических реакций
Движущей силой химической реакции является стремление реагирующих молекул занять наиболее устойчивое состояние, т.е. состояние с наименьшей свободной энергией, или энергией Гиббса (G):
G
A + B
A + B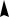
DG
C + D
∆ G<0 – снижение свободной энергии системы – условие протекания реакции
C + D
∆ G= ∆ H - T ∆ S
Константа равновесия связана со стандартной энергией Гиббса
lnКр=-∆G 0 /RT
-∆G0 =RTlnКр=2,303RTlgKp
∆ G>0, Кр<1; |
координата реакции |
|
|
∆ G<0, Кр>1; |
|
∆ G=0, Кр=1. |
|

Энергетика органических реакций
∆ G = ∆ H - T ∆ S
ΔH < 0 ΔS > 0 ΔG < 0
ΔH > 0 ΔS < 0 ΔG > 0
ΔH < 0 ΔS < 0
ΔG > 0, ΔG < 0
ΔH > 0 ΔS > 0
ΔG > 0, ΔG < 0
C2H5–O–C2H5 + 6O2 = 4CO2 + 5H2O
(реакция возможна при любой температуре)
реакция невозможна
N2 + 3H2 = 2NH3 (возможна при низкой температуре)
N2O4(г) = 2NO2(г) (возможна при высокой температуре)
Энергетика органических реакций
Движущей силой химической реакции является стремление реагирующих молекул занять наиболее устойчивое состояние, т.е. состояние с наименьшей свободной энергией, или энергией Гиббса (G):
Джозайя-Уиллард Гиббс (11.02.1839-28.04.1903)
∆ G = ∆ H - T ∆ S

Изменение
энергии
системы
Изменение
энергии
системы
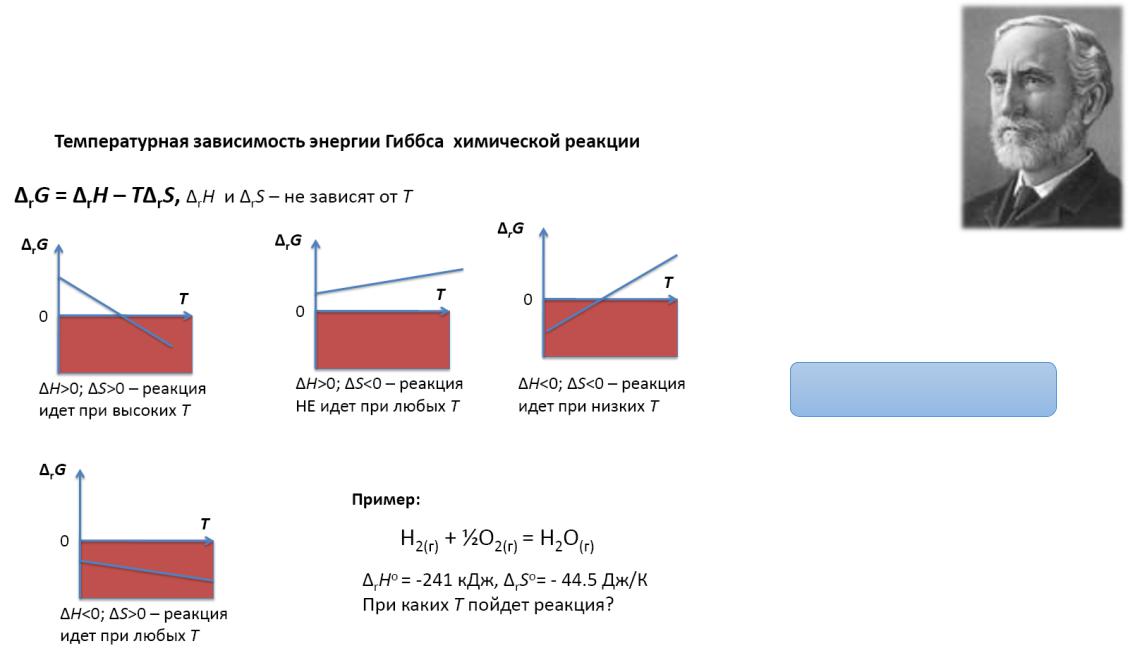
Термодинамический анализ не дает ответа на вопрос:
как быстро протекает реакция |
! "# $ % + 6 & ↔ 6 & + 5 & |
Свободная энергия
Исходные
вещества
−∆
Продукты
Свободная энергия
Исходные
вещества
−∆
∆ "
Продукты
Энергия активации
Øпервое условие протекания реакции - столкновение реагирующих молекул;
Øне каждое столкновение приводит к реакции;
Øреагируют только те молекулы, кинетическая энергия ЕК которых достаточна для преодоления отталкивания электронных оболочек;
Øэта энергия называется энергией активации Еа [кДж/моль].

Химическая кинетика |
ØСтехиометрия не всегда определяет |
|
форму кинетического уравнения |
' + ( → ' + (= ' [ (]
' ' + & → ' & +
( + & ' медленно & + − & ' /0! & ' + (
= ' ' [ (]
Врамках химической кинетики рассматриваются закономерности, определяющие зависимость скорости
химической реакции от строения реагирующих веществ, их концентрации, температуры, свойств среду,
присутствия катализаторов и любых внешних воздействий на систему.
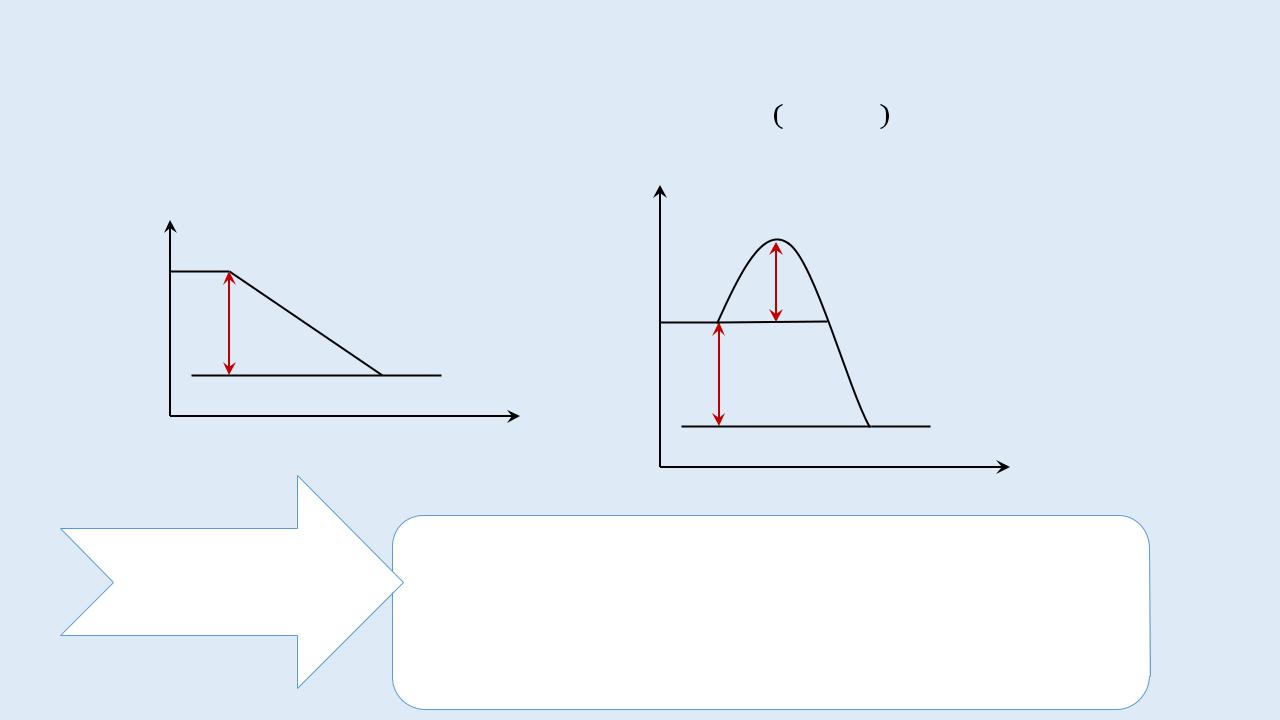
Свободная энергия
Переходное состояние без катализатора
Переходное состояние на лимитирующей стадии в присутствии катализатора
Исходные
вещества
Продукты
Органические реакции, как правило, многостадийны, т.е. протекают через ряд элементарных стадий
Свободная энергия
Переходное
состояние
Исходные " вещества ∆
−∆
Продукты
Свободная энергия
Исходные |
|
|
∆ " Промежуточное |
вещества |
∆ " |
|
соединение |
|
|
|
|
−∆ |
|
|
Продукты |
|
|
|
ØЧисло взаимодействующих частиц, которые принимают участие в реакции на данной стадии, называют
молекулярностью этой стадии.
ØРеакции или отдельные стадии этих реакций могут быть мономолекулярными, бимолекулярными или тримолекулярными.
ØЛимитирующая стадия – самая медленная стадия всей сложной реакции. Закономерности всего процесса определяются кинетическими закономерностями именно этой стадии.
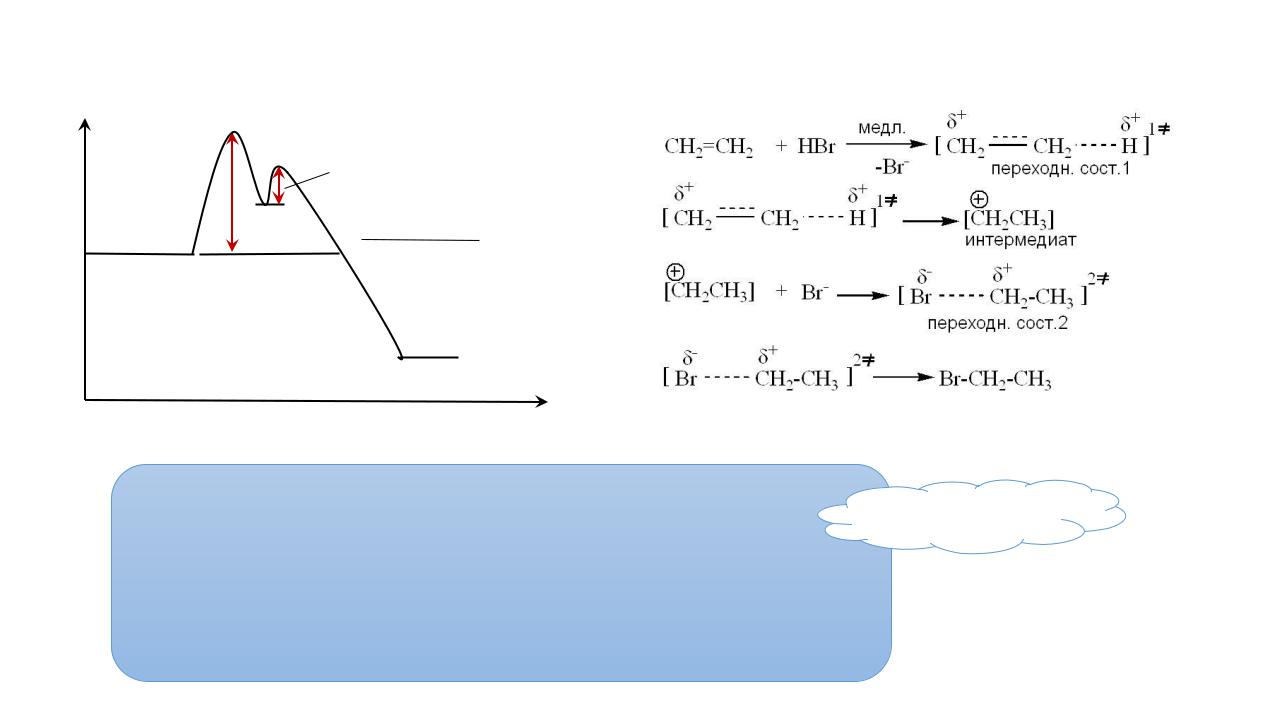
G
1≠
" ∆
CH2=CH2 + HBr
ПРИМЕР: электрофильное присоединение HBr к этилену
2≠ ∆ "
 Интермедиат
Интермедиат
Br-CH2-CH3
ØЭнергия активации - характеристика реакции в целом, а не |
Важно! |
вещества; |
Ø Энергия активации - это минимальная энергия, которой должны обладать молекулы сверх своей нулевой энергии,
чтобы произошло рассматриваемое химическое превращение.
