
Timin__Lektsii_po_biokhimii
.pdfот автора
Что такое биохимия?
Существует множество определений этого термина:
Биохимия (биологическая, или физиологическая химия) по Википедии это:
–"наука о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности."
Биохимия по энциклопедии Кольера это:
–"наука, которая описывает на языке химии строение и функции живых организмов."
Биохимия по энциклопедии Брокгауза и Ефрона это:
–греч., учение о химических процессах в живых существах."
Биохимия (биол. химия) по XuMuK.ru:
–"изучает хим. состав и структуру в-в, содержащихся в живых организмах, пути и способы регуляции их метаболизма, а также энергетич. обеспечение процессов, происходящих в клетке и организме."
Однако все эти определения не дают ответ на вечный вопрос студентов:
–Зачем врачу нужна биологическая химия?
Студентам, по их молодости, еще трудно понять значимость фундаментальных дисциплин, хочется скорее, как они выражаются, "начать изучать медицину".
Отступая от прямого ответа на поставленный вопрос, обращу внимание читателя на ту лавину знаний, которая обрушивается на студента-медика в первые три года пребывания в медицинском университете. Часть этих знаний как бы не имеет отношения к медицине – ла-
тинский язык, химия, физика, гуманитарные дисциплины, но их задача – сформировать представление о целостности нашего мира, о его единстве и неразрывности явлений.
Еще одна группа наук – медицинские науки, это анатомия, гистология, физиология и биохимия человека, патоанатомия и патофизиология, фармакология. Их значение можно сравнить с древним представлением об устройстве мира. Анатомия, гистология, цитология
– океан, без которого все остальное не имеет значения. Биохимия, физиология и патофизиология – три кита в этом океане. Они сообщают будущему врачу о принципах функционирования организма, о химических процессах в живой материи. Их задача – проложить мосты в клинические дисциплины, дать врачу возможность понять суть процесса, вызывающего болезнь.
Все клинические дисциплины базируются на этих трех китах, плавающих в океане. Убираем китов – и остаются только больное место и ничем необоснованные гадания о типе болезни, ее причинах и способах лечения.
Если попытаться сформулировать иначе, то все поле медицинских знаний можно поделить на три зоны:
Зона 1. Клеточно-молекулярный и межорганный уровень жизни – этим занимается биохимия и физиология.
Зона 2. Процессы, порождающие болезни – здесь на первом плане патологическая анатомия и патологическая физиология.
Зона 3. Внешние проявления болезней с их симптомами и синдромами. Ликвидация этих проявлений.
Многие врачи полностью находятся в третьей зоне. И что самое печальное – они даже не понимают необходимости выйти во вторую зону, не говоря уж о первой. Без комплексных знаний биологической химии, физиологии и патофизиологии такие врачи уподобляются собаке Павлова, которую выдрессировали нажимать на кнопки при зажигании лампочки. Они знают, что делать при симптомах, описанных в учебнике, хорошо зазубрили алгоритм действий в рамках своей узкой специализации, но оказываются в тупике, когда что-то идет не так. Потому что не знают и не понимают основ... А "как-то не так" идет очень часто, в "чистом" виде болезней практически не бывает.
Строение, свойства и классификация аминокислот и белков |
2 |
|
|
Настоящему врачу надо уметь видеть и увязывать в единое целое функционирование разных органов, как например, кишечник и нервная система, печень и кожа, кишечник и бронхи, видеть единство разных процессов, например, стеаторея и аллергия, кровоточивость и дисбактериоз. При этом не просто увязывать, а находить причинно-следственные связи. И только после этого врачу, вернее пациенту, может помочь фармакология – не снять симптомы, а по-настоящему помочь. Но и здесь без знаний первой зоны не обойтись, ведь лекарства зачастую обладают массой побочных эффектов, список которых превосходит перечень показаний. Нетрудно понять, что побочные эффекты лекарств – это вмешательство в химические процессы клеток, т.е. в биохимию!
Итак, необходимость биологической химии для того, кто хочет излечивать, а не просто лечить, не подлежит сомнению.

biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
3 |
|
|
|
С О К Р А Щ Е Н И Я , В С Т Р Е ЧАЮ ЩИ Е С Я В Л Е К Ц И Я Х
Аминокслоты и белки
АК – аминокислоты
Нуклеотиды
АМФ, АДФ, АТФ – аденозинмоно-, ди-, трифосфорная кислота
ГМФ, ГДФ, ГТФ – гуанозинмоно-, ди- ,трифосфорная кислота
ЦМФ, ЦДФ, ЦТФ – цитидинмоно-, ди- ,трифосфорная кислота
ТМФ, ТДФ, ТТФ – тимидилмоно-, ди- ,трифосфорная кислота
УМФ, УДФ, УТФ – уридилмоно-, ди- ,трифосфорная кислота
ФРДФ – фосфорибозилдифосфат РНК – рибонуклеиновые кислоты –
ДНК – дезоксирибонуклеиновые кислоты
Витамины
НАД и НАДН – никотинамидадениндинуклеотид окисленный и восстановленный НАДФ и НАДФН – никотинамидадениндинуклеотидфосфат окисленный и восста-
новленный ФАД и ФАДН2 - флавинадениндинуклеотид
окисленный и восстановленный ФМН и ФМНН2 – флавинаденинмононук-
леотид окисленный и восстановленный ПальФ и ПаминФ – пиридоксальфосфат и
пиридоксаминфосфат ТДФ – тиаминдифосфат
ТГФК – тетрагидрофолиевая кислота
Ферменты
АСТ – аспартатаминотрансфераза (иногда сокращают АсАТ)
АЛТ – аланинаминотрансфераза (иногда сокращают АлАТ)
ЛДГ – лактатдегидрогеназа ЩФ – щелочная фосфатаза
Углеводы
ПФП – пентозофосфатный путь
ГлюТ – чрезмембранный глюкозный транспортер
ЦТК – цикл трикарбоновых кислот
Липиды
ФЛ – фосфолипиды ХС – холестерол
сХС – свободный холестерол эХС – этерифицированный холестерол ФС – фосфатидилсерин ФХ – фосфатидилхолин
ФЭА – фосфатидилэтаноламин ФИ – фосфатидилинозитол МАГ – моноацилглицерол ДАГ – диацилглицерол ТАГ – триацилглицеролы
НЖК – насыщенные жирные кислоты ПНЖК – полиненасыщенные жирные кисло-
ты ЖК – жирные кислоты
ХМ – хиломикроны ЛПНП – липопротеины низкой плотности
ЛПОНП – липопротеины очень низкой плотности
ЛПВП – липопротеины высокой плотности
Гормоны
АКТГ – адренокортикотропный гормон ЛГ – лютеинизирующий гормон ЛТГ – лактотропный гормон
ФСГ – фолликулостимулирующий гормон МСГ – меланоцитстимулирующий гормон СТГ – соматотропный гормон ТТГ – тиреотропный гормон
Т3 и Т4 – трийодтиронин и тироксин ИЗСД – инсулинзависимый сахарный диабет ИНЗСД – инсулиннезависимый сахарный
диабет

СТРОЕНИЕ, СВОЙСТВА И КЛАССИФИКАЦИЯ АМИНОКИСЛОТ И БЕЛКОВ
Аминокислоты по строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Они являются строительными блоками белковых молекул, но необходимость их изучения кроется не только в данной функции.
Несколько аминокислот являются источником для образования нейромедиаторов в ЦНС (гистамин, серотонин, гамма-аминомасляная кислота, дофамин, норадреналин), другие сами являются нейромедиаторами (глицин, глутаминовая кислота).
Те или иные аминокислоты необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др.).
Аминокислота тирозин целиком входит в состав гормонов щитовидной железы и мозгового вещества надпочечников.
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма (цистиноз, гомоцистеинемия, лейциноз, тирозинемии и др). Самым известным примером является фенилкетонурия.
К Л АС С И Ф И К А Ц И Я АМ И Н О К И С Л О Т
Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты делятся:
1.В зависимости от положения аминогруппы.
2.По абсолютной конфигурации молекулы.
3.По оптической активности.
4.По участию аминокислот в синтезе белков.
5.По строению бокового радикала.
6.По кислотно-основным свойствам.
7.По необходимости для организма.
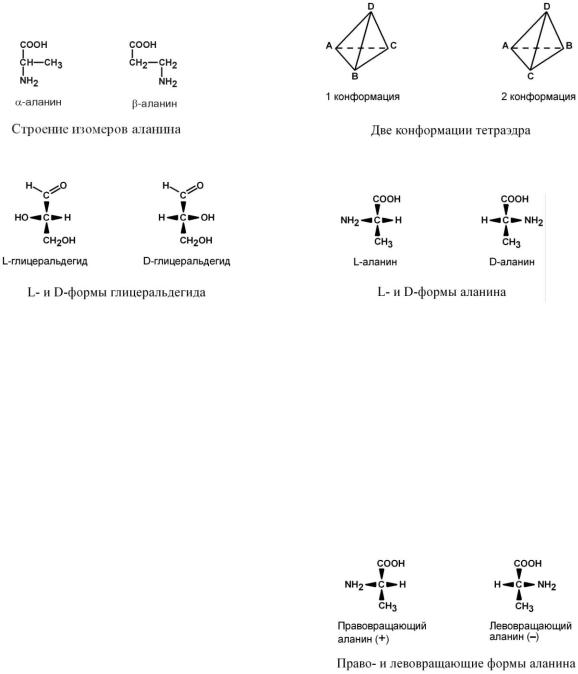
Взависимости от положения аминогруппы
Выделяют и другие аминокислоты. Для организма млекопитающих наиболее характерны -аминокислоты.
biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
5 |
|
|
|
По абсолютной конфигурации молекулы
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в-положении.
В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму. Это обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).
По оптической активности
По оптической активности аминокислоты делят-
ся на право- и левовращающие.
Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В
соответствии с углом поворота выделяют правовращающие (+) и левовращающие (-) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
По участию аминокислот в синтезе белков
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются -аминокислотами.
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:

Строение, свойства и классификация аминокислот и белков |
6 |
|
|
o по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные),
o электрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты,
o физиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг, Гис), т.е.их синтез происходит в недостаточном количестве.

biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
7 |
|
|
|
АМ И Н О К И С Л О Т Ы К АК Л Е К АР С Т В Е Н Н Ы Е П Р Е П АР АТ Ы
Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени.
Метионин ("ациметион")и его активные производные (как вещество "адеметионин" в составе препарата "Гептрал") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов.
Глутаминовая кислота – является предшественником -аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы (препараты "Аминалон", "Пикамилон"). ГАМК также играет значительную роль в регуляции тонуса мозговых сосудов кровообращении головного мозга. Сам по себе глутамат является нейромедиаторной аминокислотой, стимулирующей передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот. Потребность организма в глутаминовой кислоте выше всех остальных аминокислот.
Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния.
Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты.
Комплексный препарат глутаминовой кислоты, цистеина и глицина "Вицеин" используют в виде глазных капель.
Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки.
Строение, свойства и классификация аминокислот и белков |
8 |
|
|
Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п.
Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), аминосол (смесь 15 аминокислот), фибриносол (гидролизат фибрина крови).
Ф И З И К О - Х И М И Ч Е С К И Е С В О Й С Т В А АМ И Н О К И С Л О Т
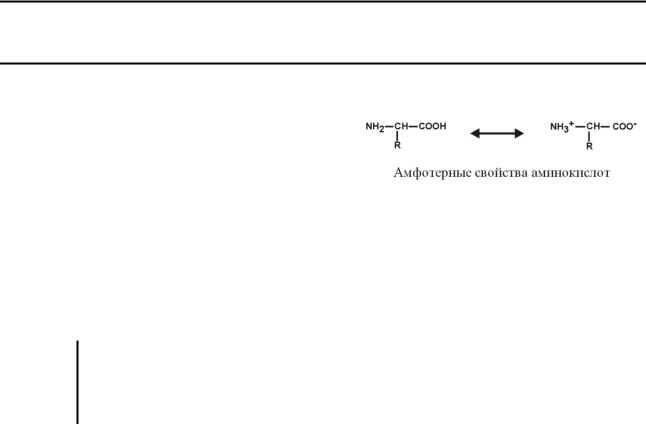
1. Являются амфотерными электролитами. Аминокислоты сочетают в себе свойства и
кислот и оснований. Соответственно, в водном растворе аминокислоты ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов.
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Ве-
личина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
o pI большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до
6,3 (пролин),
o pI кислых аминокислот – рI глутамата 3,2, рI аспартата 2,8,
o pI основных аминокислот – pI гистидина 7,6, pI аргинина 10,8, pI лизина 9,7.
Изоэлектричесая точка гистидина позволяет ему использоваться в буферной системе гемоглобина, в котором он содержится в большом количестве. Гемоглобин легко принимает и легко отдает ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
2. Заряд аминокислот зависит от величины рН среды.
Отправным пунктом для понимания причин появления заряда у аминокислот является величина изоэлектрической точки. Ситуация различается для нейтральных, кислых и основных аминокислот.

biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
9 |
|
|
|
С Т Р О Е Н И Е И С В О Й С Т ВА П Е П Т И Д Н О Й С В Я З И
Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула.
Пептидная связь – это связь между -карбоксильной группой одной аминокислоты и-аминогруппой другой аминокислоты.
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным.
Например, аланил-серил-триптофан или -глутаминил-цистеинил-глицин (по-другому называемый глутатион).
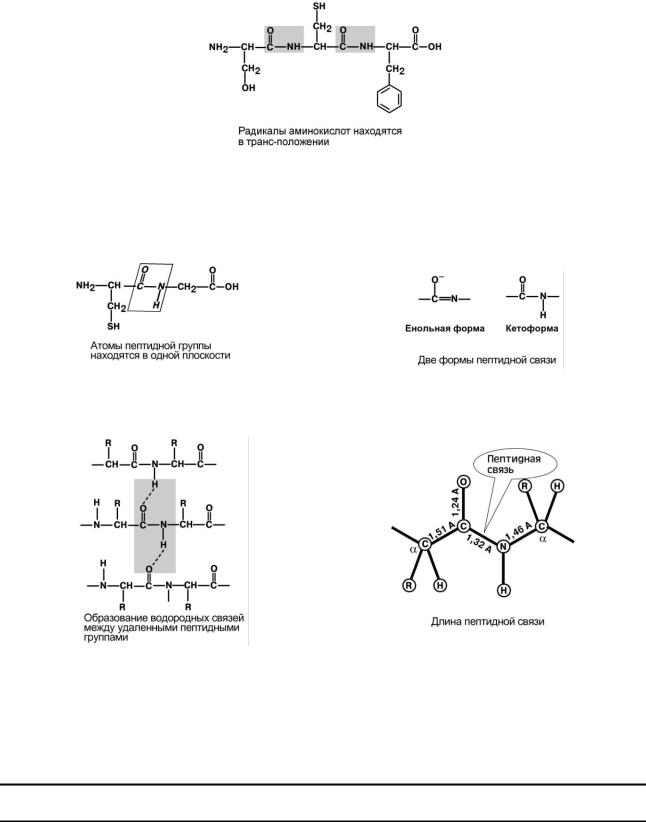
Ксвойствам пептидной связи относятся:
1.Трансположение заместителей (радикалов) аминокислот по отношению к C-N связи.
Строение, свойства и классификация аминокислот и белков |
10 |
|
|
2. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
3. Наличие кетоформы и енольной формы.
4. Способность к образованию двух водородных связей с другими пептидными группами.
5. Пептидная связь имеет частично характер двойной связи. Ее длина меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено.
Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Ф У Н К Ц И И Б Е Л К О В
1. Структурная:
o в соединительной ткани – коллаген, эластин, кератин,
oпостроение мембран и формирование цитоскелета (интегральные, полуинтегральные
иповерхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности),
