
U10sUZIsoo
.pdf
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный электротехнический университет «ЛЭТИ»
МЕТОДЫ И СРЕДСТВА ИЗМЕРЕНИЯ
ТЕМПЕРАТУРЫ
Методические указания к практическим занятиям
Санкт-Петербург Издательство СПбГЭТУ «ЛЭТИ»
2014
УДК 621.365.5
Методы и средства измерения температуры: метод. указания к практ. занятиям / сост.: А. Ю. Печенков, С. А. Галунин, К. Ю. Блинов. СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2014. 48 с.
Рассматриваются методы и средства контактного измерения температур тел. Главный упор сделан на теоретические основы контактных методов измерения температур в диапазоне от комнатных до 2800 К, принципы работы измерительных средств, рассмотрение особенностей их эксплуатации в условиях воздействия дестабилизирующих факторов с целью возможного снижения возникающих погрешностей измерения. Приведены описания конструктивных особенностей приборов различных типов.
Предназначены для подготовки магистров по направлению 140400.62 – «Электроэнергетика и электротехника», также могут быть полезны инженер- но-техническим работникам и студентам других специальностей.
Утверждено редакционно-издательским советом университета
в качестве методических указаний
СПбГЭТУ «ЛЭТИ», 2014
2
1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
1.1. Понятие температуры
Температура – важнейший параметр технологических процессов многих отраслей промышленности. По оценкам отечественных и зарубежных экспертов, технические измерения температуры составляют до 50 % от общего числа всяких измерений, поэтому качество температурного контроля часто обуславливает успех процесса производства. В связи с этим важнейшими задачами, стоящими перед современными специалистами, являются выбор надежного метода измерения температуры и измерительного прибора применительно к конкретному производству; понимание влияний на результат измерений всей совокупности факторов, сопутствующих измерительному процессу.
Свойство температуры наглядно проявляется в простом эксперименте. Если два тела – одно более нагретое, а второе менее – привести в тесный контакт и изолировать от внешних источников тепла, то температура первого тела начнет снижаться, а второго увеличиваться: одно тело отдает другому избыток имеющейся у него внутренней энергии. Процесс изменения температур будет проходить до тех пор, пока температуры тел не уравняются. Следовательно, температуры тел – уровни их внутренней энергий – определяют интенсивность теплообмена между ними и указывают направление передачи тепловой энергии.
Общее определение понятия температуры можно сформулировать следующим образом. Температура – статистически формирующаяся термодинамическая величина, определяемая уровнем внутренней энергии тела. Носителями внутренней энергии являются атомы и молекулы тела, кинетическая энергия движения которых определяет температуру.
В процессе соударений молекул происходит обмен их количества движения и выравнивание распределения энергии между ними, т. е. устанавливается равновесное состояние, при котором все формы кинетической энергии ансамбля молекул и атомов тела (поступательного, колебательного, вращательного движения) характеризуются одинаковым распределением температуры. Такую равновесную температуру T принято называть термодинамической.
Для данной температуры кинетическая энергия каждой отдельной молекулы может существенно отличаться от средней энергии. Поэтому понятие температуры является статистическим и применимо только к телу, состоя-
3
щему из очень большого числа молекул. В применении к отдельной молекуле понятие температуры не имеет смысла.
В пространстве с крайне разреженной материей температура не может быть определена статистическим распределением скоростей движения моле-
кул, поскольку в этих условиях статистические соотношения неприменимы.
Температура такого пространства определяется мощностью пронизывающих его потоков лучистой энергии. За его температуру принимают температуру
абсолютно черного тела с такой же мощностью излучения.
Точно так же не имеет физического смысла понятие температуры в не-
которой точке данного тела. Можно говорить только о температуре, характе-
ризующей состояние вещества внутри некоторого объема тела, точнее, тела
конечной массы.
Так как температура является мерой кинетической энергии, а следова-
тельно, и скорости движения материальных частиц, то должен существовать верхний предел температур, встречающихся в природе. Из теории относи-
тельности следует, что материальные частицы не могут обладать скоростями движения, превышающими скорость света. Выполненные в связи с этим рас-
четы показывают, что верхний предел возможных в природе температур со-
ставляет около 1012 К. Действительно, все наблюдаемые при различных про-
цессах температуры укладываются внутри интервала от 0 до 1012 К.
Термодинамическая температура входит в фундаментальные соотноше-
ния, определяющие либо характер протекания ряда физических процессов,
либо связь с другими физическими величинами. К таким фундаментальным соотношениям, использующимся для измерения термодинамической темпе-
ратуры, следует отнести:
1. Уравнение состояние идеального газа – уравнение Клайперона:
pV = RгT , |
(1.1) |
где p и V – давление и объем газа соответственно; Rг – универсальная газовая постоянная.
2. Закон Кюри:
µ = c T ,
T ,
где µ – магнитная восприимчивость парамагнитной соли; c – постоянная,
определяемая при градуировке.
4

3. Уравнение Найквиста, определяющее интенсивность тепловых шумов
на концах активного сопротивления R, названных флуктуациями носителей заряда в проводнике:
|
|
2 dν = 4hRν(exp h ν kT −1)−1 , |
(1.2) |
|||
dU |
||||||
где h – постоянная Планка; ν – |
частота. |
|
|
|||
4. Формула Планка, определяющая свойства теплового излучения абсо- |
||||||
лютно черного тела для длины волны λ: |
|
|
||||
E0 |
= c λ−5 (exp(c λT ) −1)−1 |
∆λ, |
|
|||
λ,T |
1 |
2 |
|
|
||
где с1 и с2 – первая и вторая постоянные Планка.
5. Уравнение, определяющее скорость звука νз в газе:
ν2з = γRT  M ,
M ,
где M – молекулярная масса газа; γ = c p  cν .
cν .
1.2. Единица температуры. Температурные шкалы
Для многих «экстенсивных» физических величин процесс их измерения заключается в экспериментальном определении числового соотношения между значением измеряемой величины и значением, условно принятым за единицу.
Температура, характеризующая внутреннюю энергию тела, относится к категории «интенсивных» физических величин и не обладает свойством аддитивности. Она требует для своего измерения наличия не только единицы, но и шкалы, по которой как бы «отсчитывается» значение измеряемого уровня температуры. За единицу температуры принят кельвин (К). Он определяется как 1/273,16 часть термодинамической температуры тройной точки воды, представляющей собой температуру равновесия трех фаз – твердой, жидкой и газообразной, – чистой воды естественного изотопного состава.
Под термином «температурная шкала» принято понимать непрерывную совокупность чисел, линейно связанных с числовыми значениями какоголибо удобно и достаточно точно измеряемого физического свойства, представляющего собой однозначную и монотонную функцию температуры. На ранней стадии развития термометрии за измеряемое термометрическое свойство принималось объемное расширение рабочей жидкости. Такие шкалы, построенные с использованием выбранного свойства конкретного рабочего тела, принято называть эмпирическими.
5
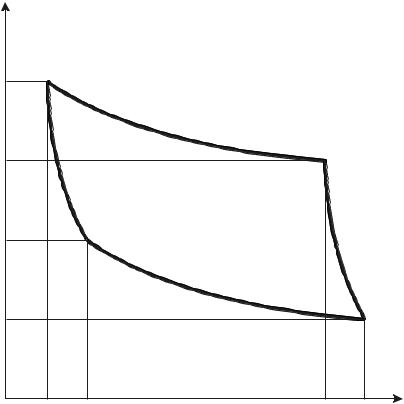
Исследования показали, что в природе практически не существует реальных тел, изменения физических свойств которых были бы строго линейно связаны с температурой. Из этого следует, что эмпирическая шкала, построенная с использованием одной рабочей жидкости, отличается от шкалы, использующей другую рабочую жидкостью. Совпадая друг с другом в основных точках, эти эмпирические шкалы давали расходящиеся значения температур как внутри интервала t2 – t1, так и вне его. Несовершенство эмпирических шкал заставило отказаться от использования конкретных термометрических свойств и искать способ построения температурной шкалы, не зависящей от свойств реальных веществ. Решение задачи было найдено на основе свойств идеальной тепловой машины, работающей по циклу Карно. Изменение состояния газа в цикле схематично представлено на диаграмме pV (рис. 1.1).
p |
|
|
|
|
|
p4 |
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
p1 |
|
|
A |
|
|
|
|
|
|
|
|
p3 |
|
C |
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
B |
|
H |
G |
E |
|
F |
0 |
V4 |
V3 |
V1 |
V2 |
V |
Рис. 1.1. Изменение состояния рабочего тела в цикле Карно |
|||||
Цикл Карно описывает изменение состояния определенной массы газа, заключенного в цилиндре с поршнем. Цилиндр окружен тепловой изоляцией и может приводиться в тепловой контакт с нагревателем температуры T1 и
холодильником температуры T2. Начальное состояние газа, например в точке
A, характеризуется значениями p1, V1 и T1 его параметров. С помощью поршня создается адиабатическое (без теплообмена с внешней средой) рас-
6

ширение газа, за счет чего его температура снижается, пока не достигнет значения T2. При этом объем газа станет V2. На диаграмме состояние соответ-
ствует точке B. Газ поршнем медленно сжимается, причем выделяющееся при сжатии тепло Q2 передается холодильнику. Изотермический при темпе-
ратуре T2 процесс сжатия газа продолжается до тех пор, пока его объем не достигнет значения V3 (в точке С диаграммы). В этот момент холодильник отключается, и при дальнейшем адиабатическом сжатии газа температура его повышается, пока не достигнет значения T1. При этом его объем принимает значение V4 (точка D диаграммы). Цикл завершен, причем производимая га-
зом полезная работа выражается площадью ABCD и получается не за счет изменения его внутренней энергии.
Из первого закона термодинамики вытекает, что количество тепла Q1,
полученного газом от нагревателя в процессе расширения, должно быть больше количества тепла Q2, отданного газом в холодильник в процессе сжа-
тия, их разность эквивалентна внешней работе газа.
Отношение количества тепла, превращенного в полезную внешнюю ра-
боту, к количеству тепла, полученного рабочим телом (газом) от источника тепла – нагревателя, называется коэффициентом полезного действия (КПД)
тепловой машины. КПД двигателя, работающего по циклу Карно, равен
η = (Q1 − Q2 ) Q1 = (T1 − T2 ) T1. |
(1.3) |
Таким образом, КПД идеальной тепловой машины определяется только значениями температур ее нагревателя T1 и холодильника T2 и не зависит от направления прохождения цикла и, что самое главное, от свойств рабочего тела.
Так как цикл Карно построен на законах термодинамики, то и темпера-
туры, входящие в (1.3), получили название термодинамических.
К такому же выражению (1.1) для КПД идеальной тепловой машины приводит круговой процесс между двумя изотермами T1 и T2 и двумя изохо-
рами (изменения состояния газа при постоянных объемах V1 и V2).
Ранее было дано определение единицы термодинамической температу-
ры – кельвина – как 1/273,16 интервала между двумя опорными точками – абсолютным нулем температур и тройной точкой воды. Тем самым опреде-
лены масштаб термодинамической шкалы и сама термодинамическая шкала с началом отсчета от абсолютного нуля температур. Начало отсчета шкалы – условное понятие, оно может быть перенесено и в другую точку. Темпера-
7
турная шкала с началом отсчета от абсолютного нуля получила название аб-
солютной температурной шкалы. Температура по этой шкале обозначается символом T, значения ее выражаются в кельвинах.
Подчеркнем, что современный принцип построения температурной шкалы базируется только на одной практически реализуемой опорной точке – тройной точке воды. Вторая опорная точка – теоретическая и практически не реализуемая точка абсолютного нуля температур.
Отсчет значений термодинамических температур может производиться от точки плавления льда, условно принимаемой за нуль. Такой шкале приписывается символ t, и значения температур, выраженные в этой шкале, сопро-
вождаются знаком °С (градусы Цельсия). Масштаб этой шкалы такой же, как и абсолютной температурой шкалы – кельвины. Градус Цельсия равен кельвину. Соотношение между числовыми значениями температур, выраженными в кельвинах и градусах Цельсия, принято точным:
Т, К = t, °С + 273,15.
В современной термодинамической шкале Цельсия температура кипения воды только приближенно равна 100 °С. Более точное ее значение 99,973 °С.
Обе температурные шкалы равноправны, и использование той или другой часто диктуется соображениями удобства.
Рассмотрим теперь цикл Карно с идеальным газом в качестве рабочего тела. Будем исходить из следующих положений.
Идеальный газ подчиняется уравнению Клайперона:
pV = RгΘ.
В отличие от (1.1), где T – абсолютная термодинамическая температура, здесь
Θ – абсолютная температура, определяющая состояние идеального газа.
Внутренняя энергия идеального газа при данной температуре не зависит от объема. Теплоемкость идеального газа при постоянном объеме и данной температуре также не зависит от объема. Кроме того, и теплоемкость при постоянном давлении не зависит от объема газа.
Поскольку внутренняя энергия идеального газа не изменяется с изменением объема, количество тепла Q1, полученного от нагревателя в процессе изотермического расширения DA (см. рис. 1.1), равняется совершенной работе. Поэтому можно написать:
8

V1
Q1 = ∫ pdV .
V4
Однако в случае изотермического расширения при температуре газа Θ
p = ( pV )1 V , где ( pV )1 – |
некоторая постоянная при температуре Θ1, поэтому |
||||||
Q = ( pV ) |
V1 |
dV |
= ( pV ) |
|
V |
||
∫ |
|
ln |
1 |
. |
|||
|
|
||||||
1 |
1 |
V |
1 |
V4 |
|||
|
|
V4 |
|
||||
Тепло Q2, отданное в холодильник, равняется работе, затраченной на изотермическое сжатие рабочего тела на участке BC, т. е.
Q2 = ( pV ) ln V2 . (1.4)
2 V3
Так как точки A и D лежат на одной и той же изотерме Θ1, то, по закону Бойля– Мариотта, p1V1 = p4V4, а для изотермы Θ2: p2V2 = p3V3.
Далее, так как точки B и A принадлежат одной и той же адиабате, то
p V γ = p V γ; |
p V γ |
= p V γ |
, |
||||||||
2 |
|
2 |
1 |
|
1 |
3 |
|
3 |
4 |
4 |
|
где γ = c p c p . |
|
|
|
|
|
|
|
|
|
|
|
Из последних двух уравнений получаем: |
|
|
|
||||||||
p V |
γ |
( p V |
γ ) |
= p V |
γ |
( p V γ ). |
|||||
2 |
2 |
3 |
3 |
1 |
1 |
4 |
4 |
|
|||
Пользуясь соотношением
p2V2 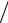 ( p3V3 ) = p1V1
( p3V3 ) = p1V1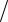 ( p4V4 ) = 1,
( p4V4 ) = 1,
которое получается из первых двух уравнений, имеем:
(V2 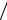 V3 )γ−1 = (V1
V3 )γ−1 = (V1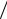 V4 )γ−1 ,
V4 )γ−1 ,
Или
V2  V3 = V1
V3 = V1 V4 .
V4 .
При подстановке (1.5) в (1.4) получаем:
Q1 − Q2 |
= |
( pV )1 − ( pV )2 |
= |
Θ1 − Θ2 |
. |
|
( pV )1 |
|
|||
Q1 |
|
Θ1 |
|||
(1.5)
(1.6)
Из сопоставления (1.6) и (1.3) приходим к формулировке одного из важ-
нейших в термометрии положений: абсолютные температуры Θ, определя-
9
ющие состояние идеального газа, совпадают с абсолютными термодинамическими температурами T.
В частном случае, при V = const, для идеального газа справедлив закон Шарля:
p |
= p (1 + αt ) , |
(1.7) |
t |
0 |
|
где p0 – давление идеального газа при термодинамической температуре T0,
являющейся началом отсчета температуры t.
В другом частном случае, при p = const, изменение объема идеального газа с температурой определяется законом Гей-Люссака:
V = V (1 + αt ) , |
(1.8) |
t 0 |
|
где V0 – объем газа при t = t0.
Из (1.7) можно определить такое значение t0, при котором pt = 0. Оче-
видно, это будет иметь место, если t0 = −1/α – абсолютный ноль температур.
Так как значение t отсчитывалось от некоторого уровня T0 термодинамиче-
ской температуры, то T0 = 1/α.
Для реальных газов уравнения (1.7) и (1.8) принимают вид
pt = p0 (1 + ανt ); νt = ν0 (1 + αpt ),
где αν и αp зависят от давления данного газа и его температуры.
По мере уменьшения начального давления p0 свойства реальных газов приближаются к свойствам идеального и
lim |
αν = lim αp = α. |
p → 0 |
p → 0 |
По результатам наиболее точных определений α принято T0 = 273,15 К. |
|
1.3. Международная практическая температурная шкала
Необходимость сопоставления результатов измерения температур в раз-
ных странах заставила искать пути создания международного эталона.
Первой попыткой в этом направлении было утверждение в 1889 г. на международной конференции по мерам и весам в качестве международного эталона температуры водородного газового термометра постоянного объема.
Эталон предназначался для измерений температур в интервале от −25 до
100 °С. В этой области температур отклонение водорода от закона идеально-
го газа очень малó, поэтому поправки на приведение к термодинамической
10
