
- •Введение
- •1. Атомно-кристаллическая структура металлов
- •1.1. Идеальные кристаллические решетки металлов
- •1.2. Кристаллизация металлов и строение металлического слитка
- •1.2.1. Первичная кристаллизация металла
- •1.2.2. Строение металлического слитка
- •1.3. Аллотропические превращения
- •1.3.1. Вторичная кристаллизация металлов
- •1.4. Фазы, образующиеся в металлических сплавах
- •2. Железо и его сплавы
- •2.1. Железо и его соединения с углеродом
- •2.2. Диаграмма состояния Fe–Fe3C. Стабильное равновесие
- •2.3. Чугуны
- •Заключение
- •Список рекомендуемой литературы

Й. Г. Беднорц и К. А. Мюллер открыли явление высокотемпературной сверхпроводимости (ВТСП) у оксидной керамики (Тс > 90 °К, YBa2Cu3O7).
1. АТОМНО-КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА МЕТАЛЛОВ
1.1. Идеальные кристаллические решетки металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов в реальном кристалле. При переходе металла из газообразного в жидкое и далее в твердое состояние расстояние между атомами уменьшается, а их взаимодействие увеличивается. Характер взаимодействия атомов определяется строением их внешних (валентных) электронных оболочек. Здесь не более трех электронов слабо связанных с ядром. При сближении атомов именно эти электроны теряют связь со своим ядром под влиянием другого атома. Происходит коллективизация электронов атомами данной массы металла. Коллективизированные электроны принято называтьсвободными.
В твердом состоянии металл представляет собой постройку из положительных ионов, омываемых «газом» из свободных электронов. Связь частиц осуществляется электростатическими силами притяжения между ионами и «газом» электронов, которые стягивают ионы. Такая связь называетсяметаллической.
Межатомные связи. Связь частиц металла в твердом состоянии показана на рис. 1.1. Первичные связи (наиболее
прочные): ионная, ковалентная, металлическая, каждая из которых возника-
ет вследствие обмена или взаимодействия (объединения) валентных электронов на s- и p-орбиталях.
Рассмотрим ионно-кулоновское взаимодействие (рис. 1.2). Изменение энергии:
E = − z1za2e2 + aCn ,
притяжение отталкивание
где z – заряды частиц; а – расстояние между ионами; С – экспериментальная константа; 6 < n < 12.
8

Еотт.(С/an)
Епр.((Z1Z2e2)/a)
Рис. 1.2. График зависимости кулоновского взаимодействия
Рис. 1.3. Атомная структура металла |
Рис. 1.4. Однозначная характеристика |
и элементарная кристаллическая ячейка |
элементарной кристаллической ячейки |
(изображена черными линиями) |
|
Одновременно между ионами существует отталкивание, которое уравновешивает притяжение, поэтому месторасположение ионов в пространстве строго определенное, а так как металл состоит из одинаковых атомов, то и расстояния между этими точками пространства должны быть равными. Это приводит к тому, что атомы (ионы) металла располагаются в пространстве закономерно, образуя кристаллическую (пространственную) решетку. Понятие это модельное, конструкция воображаемая (рис 1.3). Наименьший объем решетки, дающий представление об атомной структуре металла в любом объеме,
называется элементарной кристаллической ячейкой. Необходимо знать харак-
теристики элементарной кристаллической ячейки: три ребра (a, b, c) и три угла между осями X, Y и Z (рис. 1.4).
Различные соотношения этих параметров образуют семь сингоний (характерных типов) кристаллических решеток. Металлы кристаллизуются в
9
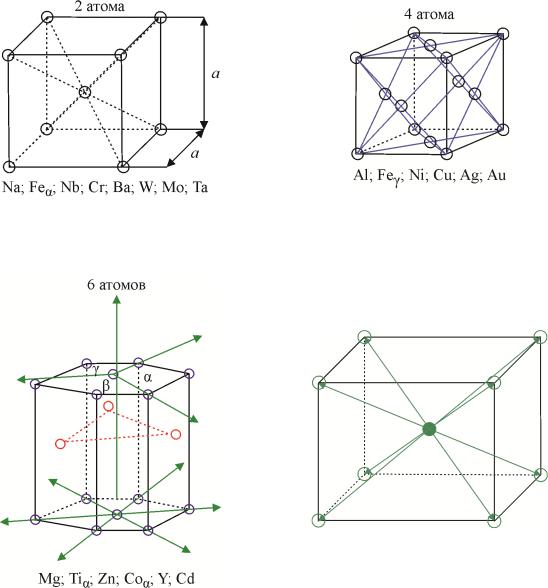
большинстве случаев либо в кубической сингонии (a = b = c; α = β = γ), либо в гексагональной сингонии (структура граненого карандаша). При этом образуется одна из следующих высокосимметричных решеток с плотной упаковкой атомов:
–объемно-центрированная кубическая (ОЦК) (рис. 1.5);
–гранецентрированная кубическая (ГЦК) (рис. 1.6);
–гексагональная, плотно упакованная (ГПУ) (рис. 1.7).
Период идентичности металлов, кристаллизующихся в кубической сингонии, находится в пределах от 2,86 до 6,07Å , а в гексагональной – период а= 2,28…3,88Å; с = 3,57…6,52 Å.
Рис. 1.5. Объемно-центрированная |
Рис. 1.6. Гранецентрированная |
кубическая (ОЦК) решетка |
кубическая (ГЦК) решетка |
с плотной упаковкой атомов |
с плотной упаковкой атомов |
Рис. 1.7. Гексагональная плотно |
Рис. 1.8. Координационное число |
упакованная (ГПК) решетка |
для объемно-центрированного куба (К8) |
с плотной упаковкой атомов |
|
10
