- •Основные положения теории химического строения а.М.Бутлерова.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •2. Классы органических соединений в зависимости от природы функциональных групп
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1. Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •3. Номенклатура предельных углеводородов
- •4. Физические свойства
- •1. Реакции замещения
- •1.1. Галогенирование
- •1.2. Нитрование алканов
- •2. Реакции разложения
- •2.1. Дегидрирование и дегидроциклизация
- •2.2. Пиролиз (дегидрирование) метана
- •2.3. Крекинг
- •3. Реакции окисления алканов
- •3.1. Полное окисление – горение
- •3.2. Каталитическое окисление
- •4. Изомеризация алканов
- •Получение алканов
- •1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- •2. Водный или кислотный гидролиз карбида алюминия
- •3. Электролиз солей карбоновых кислот (электролиз по Кольбе)
- •4. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- •5. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
- •6. Синтез Фишера-Тропша
- •7. Получение алканов в промышленности
- •2. Изомерия алкенов
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.2 Номенклатура алкинов (ацетилена)
- •11.3 Изомерия алкинов
- •2. Галогенирование.
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •2. Номенклатура
- •3. Классификация
- •4. Изомерия спиртов
- •5. Физические свойства
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •2. Окисление
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Номенклатура
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез Реакция Канниццаро:
- •Реакция Гриньяра:
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •Осбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Ароматические углеводороды. Бензол: строение, изомерия, номенклатура
- •Структура бензола
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислоты называют:
- за основу выбирают наиболее длинную углеродную цепочку, содержащую группу –СООН;
- добавляют к названию соответствующего углеводорода окончание «овая» и слово «кислота»;
- первый номер присваивается атому углерода, входящему в состав карбоксильной группы.
Например:
СН3-СН2-СООН — пропановая кислота,
СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота. По рациональной номенклатуре:
- к названию углеводорода добавляют окончание «карбоновая» и слово «кислота»;
- название углеводорода без атома углерода карбоксильной группы.
Например, С5Н9СООН — циклопентанкарбоновая кислота,
Травиальная номенклатура:
HCOOH – муравьиная кислота (метановая кислота – ИЮПАК)
СH3COOH –уксусная кислота (этановая кислота – ИЮПАК)
С3H7COOH –масляная кислота (бутановая кислота – ИЮПАК)
Классификация
В зависимости от радикала, связанного с карбоксилом, различают:
- карбоциклические (содержат циклы);
- ациклические или алифатические (не содержат циклы);
- гетерофункциональные (в углеводородном радикале атомы водорода замещены на другие атомы или группы атомов).
По числу карбоксильных групп, различают:
- одноосновные;
- двухосновные;
- многоосновные.
а) Карбоциклические (содержат циклы):
ароматические - карбоциклические соединения, имеющие бензольное кольцо:
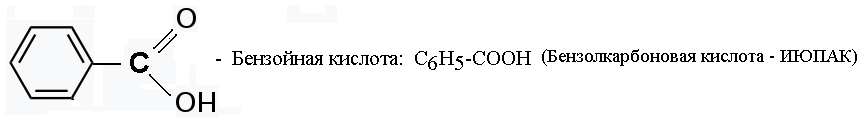
алициклические - все карбоциклические соединения, кроме ароматических:

гетероциклические - карбоксильная группа соединена с гетероциклическим радикалом. Гетероциклические соединения (гетероциклы) — органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов.
![]()
б) Ациклические или алифатические (не содержат циклы):
- радикал содержит одинарные (насыщенные связи) – пентановая (капроновая) кислота: С5H11-COOH;
- радикал содержит двойные (ненасыщенные связи) – этеновая (акриловая) кислота: СH2= СH- COOH.
В) Гетерофункциональные карбоновые кислоты
К гетерофункциональным (гетеро – другой) карбоновым кислотам относятся производные карбоновых кислот, в углеводородном радикале которых один или несколько атомов водорода замещены на другие атомы или атомные группы (заместители): галоген, гидроксигруппу; альдегидную, кетонную, аминную огруппы.
Гетерофункциональные карбоновые кислоты — это бифункциональные соединения: они обладают свойствами карбоновых кислот и свойствами того класса органических соединений, который определяет заместитель в углеводородном радикале.
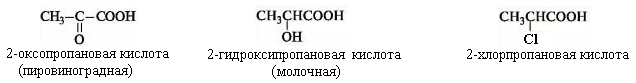
г) По числу карбоксильных групп - СООН:
одноосновная – монокарбонавая (уксусная кислота)
двухосновная - дикарбонавая (щавелевая кислота)
многоосновная - трикарбонавая (лимонная кислота) – самые сильные.
Изомерия
Изомерия — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Для карбоновых кислот характерна структурная, пространственная изомерия и изомерия гетерофункциональных кислот.
Структурная изомерия

Пространственная изомерия (цис-транс- изомерия)
(радикалы СН3 и СООН в молекуле этена заменили водород и расположились по одну (цис) или по разные (транс) стороны от плоскости, проходящей через ось, связывающую атомы углерода).
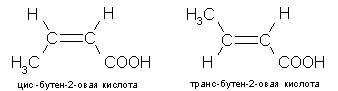
Изомерия гетерофункциональных кислот (это изомерия положением функциональных групп).
СН3—СН2—СНСl—СООН СН3—СНСl—СН2—СООН СН2Сl—СН2—СН2—СООН
2-хлорбутановая кислота 3-хлорбутановая кислота 4-хлорбутановая кислота
Особенности строения карбоксильной группы. Физические свойства
Строения карбоксильной группы (СООН) определяется строением электронной оболочки, связями и значениями электроотрицательности атомов: О(3,5); С(2,5); Н(2,1).
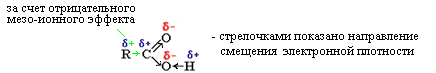
Углерод находится в состоянии sp3 гибридизации, что обеспечивает его двойную (σ-π) связь с кислородом (С= О) и одинарную σ – связь с гидроксильной группой ОН.
Карбоксильная группа (СООН) включает в себя две функциональные группы – карбонил (СО) и гидроксил (ОН), взаимно влияющие друг на друга и на радикал (R).
Электронное строение карбоксильной группы, смещение электронных плотностей придает карбоновым кислотам характерные химические и физические свойства:
- Cмещение электронной плотности в сторону кислорода карбонильной группы (С →О) вызывает дополнительную поляризацию связи в гидроксильной группе (О: Н) – отрицательный мезо-ионный эффект, это, в свою очередь, усиливает кислотные свойства (отрыв протона Н+).
В водном растворе карбоновые кислоты диссоциируют на ионы:
![]()
- Cмещение электронной плотности в сторону углерода карбонильной группы (С →О) вызывает уменьшение поляризации связи в ОС - ОН (отрицательный мезо-эффект), что делает разрыв этой связи маловероятным, но сохраняется возможность реакции замещения:
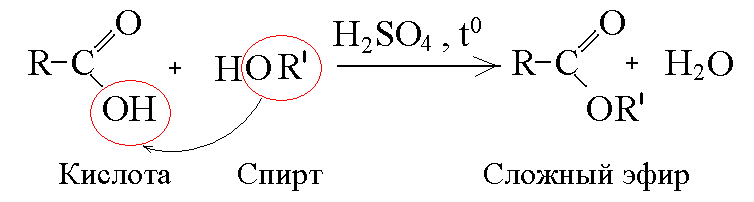
- Cмещение электронной плотности в сторону углерода карбоксильной группы (отрицательный мезо-ионный эффект), приводит к появлению положительного заряда на атомах углерода углеводородного радикала (R), что, в свою очередь, усиливает поляризацию связей С-Н, а следовательно, в конечном итоге химическую активность молекулы.
Основные физические свойства
- Если число атомов углерода в цепи не превышает пяти, то это резко пахнущие, подвижные и летучие жидкости ,хорошо растворимые в воде (с увеличением числа атомов – растворимость уменьшается).
- Более пяти - тяжелые маслянистые вещества,
- Больше девяти - твердые, парафинообразные (нерастворимы в воде).
- Температура кипения: чем больше цепь, тем выше показатель. Чем более разветвленная структура, тем ниже.
- Температура плавления: зависит от четности количества атомов углерода в цепи. У четных она выше, у нечетных ниже.
- Способны образовывать прочные водородные связи.
Способы получения кислот
(реакции окисления, через реактив Гриньяра, через нитрилы)
Существует несколько основных способов, которыми можно получать предельные карбоновые кислоты, рассмотрим некоторые из них.
Реакция окисления
Уксусную кислоту в промышленности получают несколькими различными способами. Самый старый из них заключается в окислении уксусного альдегида кислородом воздуха в присутствии различных катализаторов, из которых наиболее эффективен ацетат кобальта.
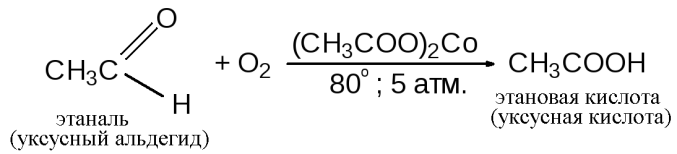
Более эффективный способ заключается в каталитическом окислении бутана с образованием двух молекул уксусной кислоты.
![]()
Получение кислот через реактив Гриньяра
Реактивы Гриньяра – имеют общую формулу RMgX и общее название – алкилмагнийгалогенид (алкил- это радикал алкана, Х – галоген).
Связь углерод – магний: полярная ковалентная. Связь магний – галоген: ионная.
Взаимодействие реактивов Гриньяра с диоксидом углерода широко применяется для синтеза карбоновых кислот.
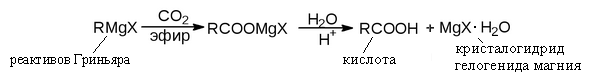
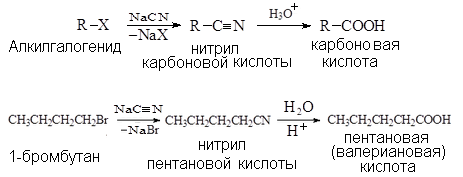
Получение кислот через нитрилы
Нитри́лы — органические соединения общей формулы R—C≡N, где группа C≡N – цианид (KCN – цианистый калий).
Название нитрилов формируется по названию соответствующей карбоновой кислоты, например: нитрил пентановой кислоты.
Алкил –это радикал алкана.
Алкилгалогениды (например: 1-бромбутан) взаимодействуя с цианидом натрия ( NaCN) образуют:
1-й этап - нитрил карбоновой (например: пентановой) кислоты.
2-й этап- нитрил гидролизуется в кислой (Н2О, Н+) до карбоновой кислоты.
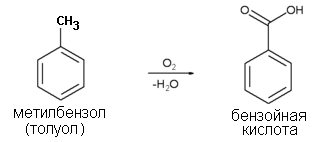
Бензойная кислота
(способы получения, влияние заместителей на кислотные свойства)
Бензо́йная кислота́— простейшая одноосновная карбоновая кислота ароматического ряда (бензольное кольцо)
Промышленное получение
В промышленных масштабах бензойную кислоту получают окислением толуола кислородом при участии катализатора (нафтената марганца или кобальта).