
- •Основные положения теории химического строения а.М.Бутлерова.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •2. Классы органических соединений в зависимости от природы функциональных групп
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1. Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •3. Номенклатура предельных углеводородов
- •4. Физические свойства
- •1. Реакции замещения
- •1.1. Галогенирование
- •1.2. Нитрование алканов
- •2. Реакции разложения
- •2.1. Дегидрирование и дегидроциклизация
- •2.2. Пиролиз (дегидрирование) метана
- •2.3. Крекинг
- •3. Реакции окисления алканов
- •3.1. Полное окисление – горение
- •3.2. Каталитическое окисление
- •4. Изомеризация алканов
- •Получение алканов
- •1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- •2. Водный или кислотный гидролиз карбида алюминия
- •3. Электролиз солей карбоновых кислот (электролиз по Кольбе)
- •4. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- •5. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
- •6. Синтез Фишера-Тропша
- •7. Получение алканов в промышленности
- •2. Изомерия алкенов
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.2 Номенклатура алкинов (ацетилена)
- •11.3 Изомерия алкинов
- •2. Галогенирование.
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •2. Номенклатура
- •3. Классификация
- •4. Изомерия спиртов
- •5. Физические свойства
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •2. Окисление
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Номенклатура
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез Реакция Канниццаро:
- •Реакция Гриньяра:
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •Осбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Ароматические углеводороды. Бензол: строение, изомерия, номенклатура
- •Структура бензола
11.5 Получение алкинов
Способы получения: дегидрирование алкенов, дегидрогалогенирование и дегалогенирование галогенпроизводных углеводородов, получение ацетилена из карбида кальция.
1. Дегидрирование алкенов (высокие температуры).
![]()
2. Дегидрогалогенирование галогенпроизводных углеводородов.
Пример: от дибромэтана отщепляются атомы водорода и брома с образованием этина (отщепление происходит под воздействием спиртового раствора щелочи).
![]()
3. Дегалогенирование галогенпроизводных углеводородов.
Отщепление хлора у тетраметана происходит в присутствии цинка:
![]()
4. Получение ацетилена из карбида кальция (гидролиз карбида кальция).
Самый старый, проверенный временем метод получения ацетилена – реакция карбида кальция с водой.
![]()
5. Крекинг метана и его гомологов (промышленный способ).
Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
![]()
или его ближайших гомологов – этана и пропана, в этом случае ацетилен образуется при более низких температурах:

Сырьем в этих способах служит природный газ или нефть.
11.6 Физические свойства алкинов
Физические свойства алкинов похожи на свойства алканов и алкенов.
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы.
При обычных условиях алкины С2Н2-С4Н6– газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Алкины имеют специфический запах.
Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами (алкенами) и парафинами (алканами). Они хорошо растворяются в органических растворителях.
Ацетилен (С2Н2) – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
![]()
11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
Присоединение воды к этину происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (этенол), который изомеризуется в уксусный альдегид (этаналь по ИЮПАК):
![]()
Присоединение воды к пропину идет через образование неустойчивого непредельного спирта (пропенола), который изомеризуется в кетон (пропанон по ИЮПАК):

Алкадиены. Классификация. Строение сопряженных алкадиенов. Номенклатура. Способы получения бутадиена-1.3 из галогенпроизводных углеводородов, из двухатомных спиртов. Химические свойства (восстановление, бромирование).
Алкадиены – непредельные ациклические углеводороды,
- относятся к гомологическому ряду диенов (углеводороды с двумя двойными связями углеродов);
- общей формула диенов СnН2n‑2 (n ≥ 3), которая совпадает с формулой для алкинов.
![]()
Отличия алкадиенов от других углеводородов в ряду диенов:
- двойные связи разделены одной и более одинарными связями ( у диенов двойные связи могут быть рядом);
- сопряженные алкадиены имеют одну одинарную связь С – С, разделяющую двойные С=С.
Сопряженные алкадиены имеют большое практическое значение. Основная сфера использования сопряженных алкадиенов и их производных – это производство каучука.

Дивинил и изопрен – традиционные (тривиальные) названия.
Дивинил – бесцветный, легко сжижающийся (при ‑4,5 °C) газ с неприятным запахом, изопрен – низкокипящая (34,1 °C) жидкость.
Строение сопряженных алкадиенов
С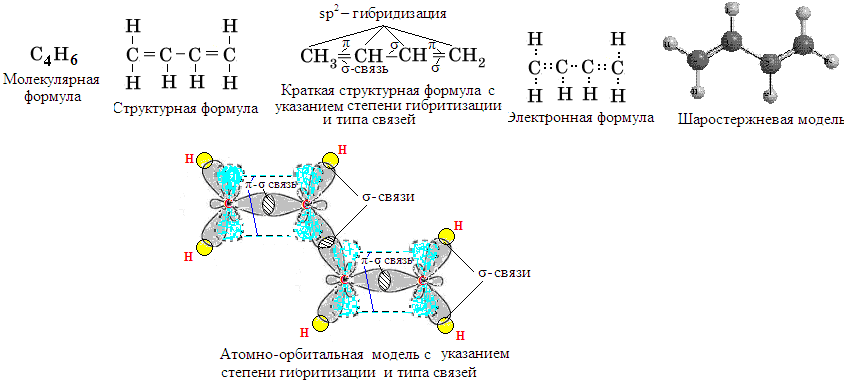 троение
углеводородов представляется в виде
формул и схем с указанием степени
гибридизации (sp2
–
гибридизация)
и типов связи между атомами (σ
и π связи).
троение
углеводородов представляется в виде
формул и схем с указанием степени
гибридизации (sp2
–
гибридизация)
и типов связи между атомами (σ
и π связи).
Например: бутадиен-1,3
Номенклатура (ИЮПАК)
- За основу названия алкадиенов принимается самая длинная цепь (образующий углеводород), которая содержит две двойные связи.
- В конце названия образующего углеводорода приписывается суффикс –диен и указываются номера атомов, после которых начинаются кратные связи.
- Отсчет номеров атомов углерода выбирается так, чтобы номер двойной связи был наименьшим, при этом боковые радикалы - заместители также должны иметь наименьшие номера и перечисляться в порядке возрастания их сложности.
- Перед названием заменителя указывается его место, если в соединении находится несколько одинаковых заместителей, то и наряду с указанием места расположения каждого заместителя, с помощью умножающих приставок (греческих числительных), указывается их количество: ди-, три-, тетра-, пента и так далее;
Например: 3,4-диметилпентадиен-1,3 CH2=CH-C(CH3)=C(CH3)-CH3
Получение бутадиена-1.3 из из двухатомных спиртов (дегидратация)
Дегидратация гликолей (отщепление молекул воды от двухатомных спиртов).
![]()
Получение бутадиена-1.3 из галогенпроизводных углеводородов (дегидрогалогенирование)
Дегидрогалогенирование (отщепление атомов водорода и галогена) при действии спиртового раствора щелочи на дигалогеналканы (например: дихлорбутан).
![]()
Синтез дивинила по Лебедеву (из одноатомных спиртов - алканолов)
![]()
Химические свойства (восстановление, бромирование).
Восстановление и бромирование относятся к реакциям присоединения
(наличие двойных связей – благоприятный фактор)
1. Гидрирование (присоединение водорода - восстановление)
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода с номерами 1 и 4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами с номерами 2 и 3:

В присутствии катализатора Ni получается продукт полного гидрирования:
![]()
2. Галогенирование – присоединение галогенов (например: бромирование – присоединения брома)
Алкадиены вступают в те же реакции присоединения, что и алкены. Сопряженные диены имеют особые свойства, в частности, в реакциях присоединения; они образуют продукты 1,4 ‑присоединения и 1, 2- присоединения.

При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
Получение дивинила (дополнительный материал).
1. Дигидрирование бутана.
![]()
2) способ Лебедева – одновременное отщепление воды и водорода от этанола (катализатор ZnO/Al2O3):
![]()
В результате полимеризации дивинила образуется полибутадиеновый каучук:
![]()
Спирты. Классификация. Одноатомные и двухатомные спирты: изомерия, физические свойства, номенклатура. Способы получения: гидратация алкенов, гидролиз галогенпроизводных углеводородов, восстановление альдегидов и кетонов, с помощью реактивов Гриньяра и карбонильных соединений. Основно-кислотные свойства. Химические свойства одноатомных спиртов.
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода одну или несколько гидроксильных групп (-OH).
Общая формула спиртов R-OH (где R – углеводородный радикал).
