
- •2.Первый закон термодинамики. Обмен энергией в форме работы и теплоты. Понятия: внутренняя энергия, энтальпия. Обмен энергией в форме теплоты. Изобарная и изохорная теплоёмкости.
- •4.Термохимия. Закон Гесса и следствия из закона г есса. Теплоты образования и теплоты сгорания. Расчёт тепловых эффектов физико-химических процессов.
- •5.3Ависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа.
- •7.Энтропия и термодинамическая вероятность. Уравнение Больцмана. Расчёт изменения энтропии в изотермическом, изобарном и изотермическом процессах.
- •8.Постулат Планка. Абсолютная энтропия. Зависимость энтропии от температуры. Расчёт энтропии при различных температурах.(задачи?)
- •9. Термодинамические потенциалы. Фундаментальное уравнение термодинамики.
- •10.Энергия Гиббса и Гельмгольца. Критерии равновесия и самопроизвольного протекания процессов. Энтальпийный и энтропийный фактор.
- •11.Фаза. Условия фазового равновесия. Правило фаз Гиббса. Понятия: независимый компонент, вариативность системы.
- •12.Равновесные соотношения при фазовых переходах (уравнение Клаузиуса-Клапейрона). Вывод уравнений линий фазового равновесия твёрдо-жидкое; жидкое-газ; твёрдое-газ для фазовой диаграммы воды.
- •13. Фазовые диаграммы однокомпонентных систем. Фазовые диаграммы воды. Фазовые переходы второго рода.
- •14. Химическое равновесие. Закон действующих масс. Константа равновесия.
- •16. Влияние температуры на химическое равновесие. Уравнение изохоры и изобары химической реакции.
- •17. Влияние на химическое равновесие. Принцип Ле-Шателье.
- •Классификация
- •19. Идеальные растворы. Закон Рауля и его вывод. Отклонения от закона Рауля.
- •Фазовая диаграмма р-состав, t-состав
- •Системы с небольшим отклонением от закона Рауля.
- •20. Закон Генри. Растворимость газов в жидкостях
- •21. Коллигативные свойства. Изменение температур кипения и замерзания растворов нелетучих веществ. Эбуллиоскопическая и криоскопическая постоянные.
- •22. Осмотическое давление. Закон Вант-Гофа.
14. Химическое равновесие. Закон действующих масс. Константа равновесия.
Химическое равновесие – это состояние, при котором свойства системы не изменяются во времени и в ней отсутствуют потоки вещества и энергии. То есть если в системе протекает одна или несколько химических реакций, то скорости в каждой паре прямой-обратной реакции будут равны между собой.
Закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих:
Скорость элементарной химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях, равных их коэффициентам. 𝑎𝐴+𝑏𝐵=𝑐𝐶+𝑑𝐷
𝑣=𝑘∗𝐶𝑎(𝐴)∗𝐶𝑏(𝐵) – кинетическое уравнение (тв. в-во не считается)

Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ.


 К
К онстанта
равновесия есть характерная величина
для каждой обратимой химической реакции;
величина
константы равновесия зависит только
от природы реагирующих веществ и
температуры.
Выражение для константы равновесия
для элементарной обратимой реакции
может быть выведено из кинетических
представлений.
онстанта
равновесия есть характерная величина
для каждой обратимой химической реакции;
величина
константы равновесия зависит только
от природы реагирующих веществ и
температуры.
Выражение для константы равновесия
для элементарной обратимой реакции
может быть выведено из кинетических
представлений.
15. Уравнение изотермы химической реакции (уравнение Вант-Гоффа).
Для растчета ΔG используют уравнение изотермы, где используют текущее давление (например изохоры)
Данное уравнение называется уравнением изотермы химической реакции:
ΔG(p,T) = ΔG0(T) + RT ln K’p
ΔG = RT ln Kp (уравнение Вант-Гоффа)
16. Влияние температуры на химическое равновесие. Уравнение изохоры и изобары химической реакции.
Повышение либо понижение температуры означает приобретение, либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия.
 1)
ΔH < 0, →
экзотермическая, ← эндотермическая
1)
ΔH < 0, →
экзотермическая, ← эндотермическая
T↑ следовательно ↓Кр, значит числитель уменьшится, а знаменатель увеличится, тогда равновесие сместится в сторону эндотермической реакции (то есть в сторону обратной реакции)
2) ΔH < 0, → эндотермическая, ← экзотермическая
T↑ следовательно ↑Кр, значит числитель увеличится, а знаменатель уменьшится, тогда равновесие сместится в сторону экзотермической реакции (то есть в сторону продуктов реакции)
Таким образом при увеличении температуры равновесие смещается в сторону эндотермической реакции, а при уменьшении в сторону экзотермической.
Уравнение изохоры и изобары:
ΔG < 0 – идет прямая реакция
ΔG > 0 – идет обратная реакция
ΔG = 0 – идет прямая и обратная реакции и их скорости равны
Уравнение изобары:
Уравнение изохоры:
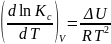
17. Влияние на химическое равновесие. Принцип Ле-Шателье.
Если на систему оказать какое-либо влияние (изм. P, C, T), то происходит сдвиг химического равновесия. При устранении внешнего влияния равновесие устанавливается вновь, но при других равновесных концентрациях. Сдвиг равновесия определяется принципом Ле-Шателье.
Принцип Ле-Шателье — внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в стoрону прямой реакции.
Катализаторы не влияют на положение равновесия, а только ускоряет его достижение (он в равной степени ускоряет прямую и обратную реакции).
18. Растворы. Способы выражения состава растворов.
Растворы – это термодинамический устойчивая гомогенна система переменного состава, состоящая как минимум из двух компонентов.
