
- •2.Первый закон термодинамики. Обмен энергией в форме работы и теплоты. Понятия: внутренняя энергия, энтальпия. Обмен энергией в форме теплоты. Изобарная и изохорная теплоёмкости.
- •4.Термохимия. Закон Гесса и следствия из закона г есса. Теплоты образования и теплоты сгорания. Расчёт тепловых эффектов физико-химических процессов.
- •5.3Ависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа.
- •7.Энтропия и термодинамическая вероятность. Уравнение Больцмана. Расчёт изменения энтропии в изотермическом, изобарном и изотермическом процессах.
- •8.Постулат Планка. Абсолютная энтропия. Зависимость энтропии от температуры. Расчёт энтропии при различных температурах.(задачи?)
- •9. Термодинамические потенциалы. Фундаментальное уравнение термодинамики.
- •10.Энергия Гиббса и Гельмгольца. Критерии равновесия и самопроизвольного протекания процессов. Энтальпийный и энтропийный фактор.
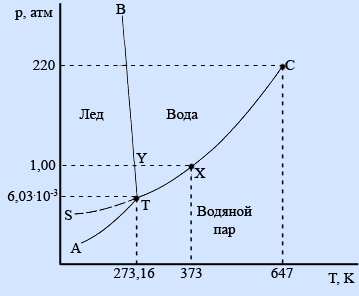
- •11.Фаза. Условия фазового равновесия. Правило фаз Гиббса. Понятия: независимый компонент, вариативность системы.
- •12.Равновесные соотношения при фазовых переходах (уравнение Клаузиуса-Клапейрона). Вывод уравнений линий фазового равновесия твёрдо-жидкое; жидкое-газ; твёрдое-газ для фазовой диаграммы воды.
- •13. Фазовые диаграммы однокомпонентных систем. Фазовые диаграммы воды. Фазовые переходы второго рода.
- •14. Химическое равновесие. Закон действующих масс. Константа равновесия.
- •16. Влияние температуры на химическое равновесие. Уравнение изохоры и изобары химической реакции.
- •17. Влияние на химическое равновесие. Принцип Ле-Шателье.
- •Классификация
- •19. Идеальные растворы. Закон Рауля и его вывод. Отклонения от закона Рауля.
- •Фазовая диаграмма р-состав, t-состав
- •Системы с небольшим отклонением от закона Рауля.
- •20. Закон Генри. Растворимость газов в жидкостях
- •21. Коллигативные свойства. Изменение температур кипения и замерзания растворов нелетучих веществ. Эбуллиоскопическая и криоскопическая постоянные.
- •22. Осмотическое давление. Закон Вант-Гофа.
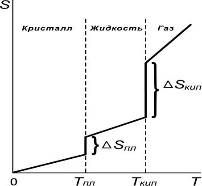
7.Энтропия и термодинамическая вероятность. Уравнение Больцмана. Расчёт изменения энтропии в изотермическом, изобарном и изотермическом процессах.
Энтропия (S)– мера неупорядоченности системы.
Уравнение Больцмана:
S=klnW, где W – ТД вероятность; k – постоянная Больцмана.
ТД вероятность(W)– величина, которая определяется числом микросостояний, которым может быть реализовано макросостояние.
 Энтропия
зависит от:
Энтропия
зависит от:
Агрегатного состояния - Sг>Sж>Sтв
От давления – чем выше давление, тем ниже энтропия
От объема – чем выше объем, тем выше энтропия
От температуры =>>
Расчёт изменения энтропии в изотермическом, изобарном и изохорных процессах:
Изотермический T=const
Фазовый переход ∆S=∆Hфп/Тфп
Расширение идеального газа ∆S= νRlnV2/V1
Изобарный P=const ∆S= νCplnT2/T1
Изохорный V=const ∆S= νCvlnT2/T1
8.Постулат Планка. Абсолютная энтропия. Зависимость энтропии от температуры. Расчёт энтропии при различных температурах.(задачи?)
Постулат Планка:
Энтропия идеального кристалла при Т=0К равна нулю.
Расчет
абсолютной энтропии:
![]()
9. Термодинамические потенциалы. Фундаментальное уравнение термодинамики.
Смысл ТД потенциала:
Падающий груз летит вниз, а не вверх, в сторону уменьшения потенциальной энергии. Т.о. самопроизвольные процессы, где ∆S<0. Когда груз достигает земли (равновесие), то изменение силы равно 0, а максимальная работа груза при падении Amax=-∆E.
Фундаментальное уравнение термодинамики:
Связывает 1 и 2 законы ТД.
Для закрытых систем:
dU=TdS-∑Yidyi
Для открытых систем:
dU=TdS-∑Yidyi+∑μidni, где μ - химический потенциал, dni – изменение числа моль для этого в-ва, ∑μidni – обмен энергией, связанный с обменом в-ва.
10.Энергия Гиббса и Гельмгольца. Критерии равновесия и самопроизвольного протекания процессов. Энтальпийный и энтропийный фактор.
Энергия Гиббса G – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы.
Энергия Гельмгольца A — это та часть внутренней энергии системы, также определяющая работоспособность и может быть применена для совершения максимальной работы.
Они не зависят друг от друга и их величины противоположны, и процесс идет в сторону той реакции, при которой изменение величины больше. Разность между этими величинами определяет свободную энергию реакции (при постоянных температуре и давлении). Ее изменение в реакции определяется разностью сумм энергий Гиббса конечных продуктов реакции и исходных веществ:
ΔG= Gкон – Gисх
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией следующим выражением:
ΔG = ΔH– TΔS
Здесь изменение энергии Гиббса учитывает одновременно изменение энергетического запаса системы и степень ее беспорядка (самопроизвольность протекания процесса).
Т.к. энергия Гиббса является мерой самопроизвольности протекания процесса, то между знаком ΔG для любой реакции и ее самопроизвольным протеканием (при постоянных температуре и давлении) существуют такие зависимости:
Если ΔG отрицательно (ΔG<0), то реакция протекает самопроизвольно в прямом направлении.
 Если
ΔG равно нулю (ΔG=0),
то реакция находится в равновесном
состоянии.
Если
ΔG равно нулю (ΔG=0),
то реакция находится в равновесном
состоянии.Если ΔG положительно (ΔG>0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
ΔH |
ΔS |
ΔG |
Протекание реакции |
˂0 |
>0 |
Всегда ˂0 |
Реакция самопроизвольна при любых температурах, обратная реакция всегда несамопроизвольна |
>0 |
˂0 |
Всегда >0 |
Реакция несамопроизвольна при любых температурах, обратная реакция самопроизвольна |
˂0 |
˂0 |
При низких температурах ˂0, при высоких температурах >0 |
Реакция самопроизвольна при низких температурах, обратная реакция становится самопроизвольной при высоких температурах |
>0 |
>0 |
При низких температурах >0, при высоких температурах ˂0 |
Реакция несамопроизвольна при низких температурах, но при высоких температурах становится самопроизвольной |
