
- •2.Первый закон термодинамики. Обмен энергией в форме работы и теплоты. Понятия: внутренняя энергия, энтальпия. Обмен энергией в форме теплоты. Изобарная и изохорная теплоёмкости.
- •4.Термохимия. Закон Гесса и следствия из закона г есса. Теплоты образования и теплоты сгорания. Расчёт тепловых эффектов физико-химических процессов.
- •5.3Ависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа.
- •7.Энтропия и термодинамическая вероятность. Уравнение Больцмана. Расчёт изменения энтропии в изотермическом, изобарном и изотермическом процессах.
- •8.Постулат Планка. Абсолютная энтропия. Зависимость энтропии от температуры. Расчёт энтропии при различных температурах.(задачи?)
- •9. Термодинамические потенциалы. Фундаментальное уравнение термодинамики.
- •10.Энергия Гиббса и Гельмгольца. Критерии равновесия и самопроизвольного протекания процессов. Энтальпийный и энтропийный фактор.
- •11.Фаза. Условия фазового равновесия. Правило фаз Гиббса. Понятия: независимый компонент, вариативность системы.
- •12.Равновесные соотношения при фазовых переходах (уравнение Клаузиуса-Клапейрона). Вывод уравнений линий фазового равновесия твёрдо-жидкое; жидкое-газ; твёрдое-газ для фазовой диаграммы воды.
- •13. Фазовые диаграммы однокомпонентных систем. Фазовые диаграммы воды. Фазовые переходы второго рода.
- •14. Химическое равновесие. Закон действующих масс. Константа равновесия.
- •16. Влияние температуры на химическое равновесие. Уравнение изохоры и изобары химической реакции.
- •17. Влияние на химическое равновесие. Принцип Ле-Шателье.
- •Классификация
- •19. Идеальные растворы. Закон Рауля и его вывод. Отклонения от закона Рауля.
- •Фазовая диаграмма р-состав, t-состав
- •Системы с небольшим отклонением от закона Рауля.
- •20. Закон Генри. Растворимость газов в жидкостях
- •21. Коллигативные свойства. Изменение температур кипения и замерзания растворов нелетучих веществ. Эбуллиоскопическая и криоскопическая постоянные.
- •22. Осмотическое давление. Закон Вант-Гофа.
1.Термодинамическая система. Параметры и функции состояния термодинамической системы. Формы обмена энергией термодинамической системы с окружающей средой. Выражение количества работы через параметры состояния термодинамической системы.
Химическая термодинамика изучает превращения химической энергии в теплоту, работу и другие энергии.
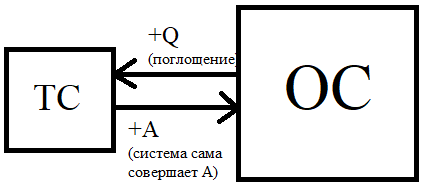
ТД изучает термодинамические системы(ТС).
ТС-часть пространства, выделяемая для изучения, которая отделена от окружающей среды(ОС) реальной или воображаемой границей.
Типы ТС:
Изолированные – отсутствуют, какие-либо формы обмена с окружающей средой.
Открытыми – система обменивается с окружающей средой энергией и веществом.
Закрытые - система обменивается с окружающей средой только энергией, обмен веществом невозможен.
Адиабатические- нет обмена веществом и нет теплообмена.
Для описания ТС:
ТД параметры
Интенсивные (не зависит от кол-ва в-ва) – t, P, δ.
Экстенсивные (зависит от кол-в в-ва) – V, m, ν.
Уравнение, которое связывет ТД параметры, называется уравнением состояния.
PV= νRT – уравнение Менделеева-Клапейрона.
Всякое изменение ТД параметров есть ТД процесс.
ТД функции
Состояния – U, H, S, G, F. Зависят от основных.
В химии наиболее часто используются:
внутренняя энергия U и её изменение U при V = const;
энтальпия (теплосодержание) H и её изменение H при p = const;
энтропия S и её изменение S;
энергия Гиббса G и её изменение G при p = const и T = const.
Для ф-ций состояния хар-но, что их изм-ние в хим. р-ции определяется только начальным и конечным состоянием системы и не зависит от пути или способа протекания процесса.
Процесса – Q, А. Зависит от пути перехода.
Q (теплота образования)- форма передачи энергии путем сталкивания молекул сталкивающихся тел; это микроскопическая неупорядоченная форма передачи энергии хаотичным движением частиц.
А(работа) – это макроскопическая форма передачи энергии упорядоченных частиц.
Теплота и работа зависят от пути процесса, следовательно, они являются функциями процесса, а не состояния. Теплоту и работу выражают в джоулях (Дж). Теплота является положительной величиной, если система ее поглощает, а отрицательной - если система её выделяет. Работа является положительной величиной, если она осуществляется системой, и отрицательной- если она осуществляется над системой.
А= P V
2.Первый закон термодинамики. Обмен энергией в форме работы и теплоты. Понятия: внутренняя энергия, энтальпия. Обмен энергией в форме теплоты. Изобарная и изохорная теплоёмкости.
Первый закон ТД(закон сохранения и превращения энергии):
В любом процессе в закрытой системе изменение внутренней энергии равно количеству сообщающейся системе теплоте за вычетом работы, которую совершает система.
∆U=Q-A
dU=δQ-δA
Внутренняя энергия системы (U, Дж) – это полная энергия системы, включающая кинетическую энергию всех видов движения молекул, атомов, ядер, электронов и других структурных единиц, а также потенциальную энергию взаимодействия и др., кроме кинетической и потенциальной энергии всей системы как целого по отношению к другим системам.
Абсолютное значение внутренней энергии определить невозможно, т.к. нельзя привести систему в состояние, полностью лишенное энергии.
Можно судить лишь об изменении внутренней энергии системы U при её переходе из начального состояния U1 в конечное U2:
U = U2 U1,
При переходе неизолированной системы из одного состояния в другое изменение её внутренней энергии осуществляется путём обмена с окружающей средой.
Основными формами обмена с окружающей средой являются совершение работы и выделение или поглощение теплоты.
Энтальпия (Н, Дж) — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту.
Н=U+pU
∆H=∆U+∆νPT,
где ∆ν – изменение числа моль газообразных веществ.
Теплоемкость (С) - это отношение количества сообщаемой системе теплоты и наблюдаемое при этом повышение Т.
Типы теплоемкости:
Средняя
С= (Дж/К)
(Дж/К)
Истинная
С=
Удельная
Молярная
Изохорная Cv
V-const, ν
Cv=
Изобарная Cp P-const, νCv=

dU= νCvdT => ∆U= νCv(T2-T1)
dH= νCpdT
Cp=Cv+R – связь изобар и изохор теплоемкости.
Для одноатомных идеальных газов Cv=3/2R, Cp=5/2R
Для идеального газа Cv=5/2R, Cp=7/2R
3.Термодинамический процесс. Обратимые и необратимые процессы. Равновесные и неравновесные процессы. Самопроизвольный процесс. Классификация термодинамических процессов в зависимости от условий их проведения.
Любое изменение термодинамически состояния системы, то есть изменение хотя бы одного параметра состояния называется термодинамическим процессом.
Состояние равновесия - состояние, при котором система не изменяется во времени, и в ней отсутствуют потоки вещества или энергии.
О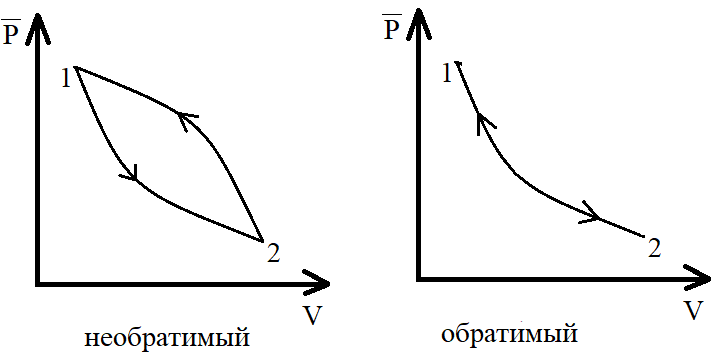 братимым
процессом является процесс,
который дает возможность возвращения
системы в исходное состояние без того,
чтобы в окружающей среде произошли
какие-либо изменения. В противном случае
процесс является необратимым.
братимым
процессом является процесс,
который дает возможность возвращения
системы в исходное состояние без того,
чтобы в окружающей среде произошли
какие-либо изменения. В противном случае
процесс является необратимым.
Равновесный процесс - процесс, в ходе которого система проходит через непрерывный ряд равновесных состояний.
НЕРАВНОВЕСНЫЙ ПРОЦЕСС - физ. процесс, включающий неравновесные состояния.
К самопроизвольным относятся процессы, проходящие без затраты энергии извне. Может происходить обратимо или необратимо. Для осуществления несамопроизвольного процесса необходимо затратить внешнюю энергию в количестве, пропорциональном величине изменения состояния системы.
Применение 1 закона ТД к некоторым процессам, в которых совершается только А расширенная:
Т=const – изотермический
∆U=0, Q=A= νRTln(V2/V1)
V=const – изохорный
A=0, ∆U=Q
P=const – изобарный
Q=∆U+p∆U, ∆H=Q, H=U+pV
Q=const - адиабатический
dU=-δA, A= νCv(T2-T1), ϒ=Сp/Cv
TVϒ-1=const => уравнение адиабаты
PVϒ=const
