
- •2.Первый закон термодинамики. Обмен энергией в форме работы и теплоты. Понятия: внутренняя энергия, энтальпия. Обмен энергией в форме теплоты. Изобарная и изохорная теплоёмкости.
- •4.Термохимия. Закон Гесса и следствия из закона г есса. Теплоты образования и теплоты сгорания. Расчёт тепловых эффектов физико-химических процессов.
- •5.3Ависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа.
- •7.Энтропия и термодинамическая вероятность. Уравнение Больцмана. Расчёт изменения энтропии в изотермическом, изобарном и изотермическом процессах.
- •8.Постулат Планка. Абсолютная энтропия. Зависимость энтропии от температуры. Расчёт энтропии при различных температурах.(задачи?)
- •9. Термодинамические потенциалы. Фундаментальное уравнение термодинамики.
- •10.Энергия Гиббса и Гельмгольца. Критерии равновесия и самопроизвольного протекания процессов. Энтальпийный и энтропийный фактор.
- •11.Фаза. Условия фазового равновесия. Правило фаз Гиббса. Понятия: независимый компонент, вариативность системы.
- •12.Равновесные соотношения при фазовых переходах (уравнение Клаузиуса-Клапейрона). Вывод уравнений линий фазового равновесия твёрдо-жидкое; жидкое-газ; твёрдое-газ для фазовой диаграммы воды.
- •13. Фазовые диаграммы однокомпонентных систем. Фазовые диаграммы воды. Фазовые переходы второго рода.
- •14. Химическое равновесие. Закон действующих масс. Константа равновесия.
- •16. Влияние температуры на химическое равновесие. Уравнение изохоры и изобары химической реакции.
- •17. Влияние на химическое равновесие. Принцип Ле-Шателье.
- •Классификация
- •19. Идеальные растворы. Закон Рауля и его вывод. Отклонения от закона Рауля.
- •Фазовая диаграмма р-состав, t-состав
- •Системы с небольшим отклонением от закона Рауля.
- •20. Закон Генри. Растворимость газов в жидкостях
- •21. Коллигативные свойства. Изменение температур кипения и замерзания растворов нелетучих веществ. Эбуллиоскопическая и криоскопическая постоянные.
- •22. Осмотическое давление. Закон Вант-Гофа.
Фазовая диаграмма р-состав, t-состав
Системы с небольшим отклонением от закона Рауля.
P-состав (Т=const)
I – область жидкости;
II – область пара;
III – равновесие ж-п;
1 – линия жидкости, позволяет определить при каком внешнем давлении закипает жидкость данного состава;
 2
– линия пара, показывает, при каком
давлении начинается конденсация пара.
2
– линия пара, показывает, при каком
давлении начинается конденсация пара.
T-состав (P=const)
1 – позволяет определить температуру, при которой начинает кипеть жидкость данного состава;
2 – позволяет определить температуру, при которой закончится конденсация пара. 2. Системы с большим отклонением от закона Рауля.
В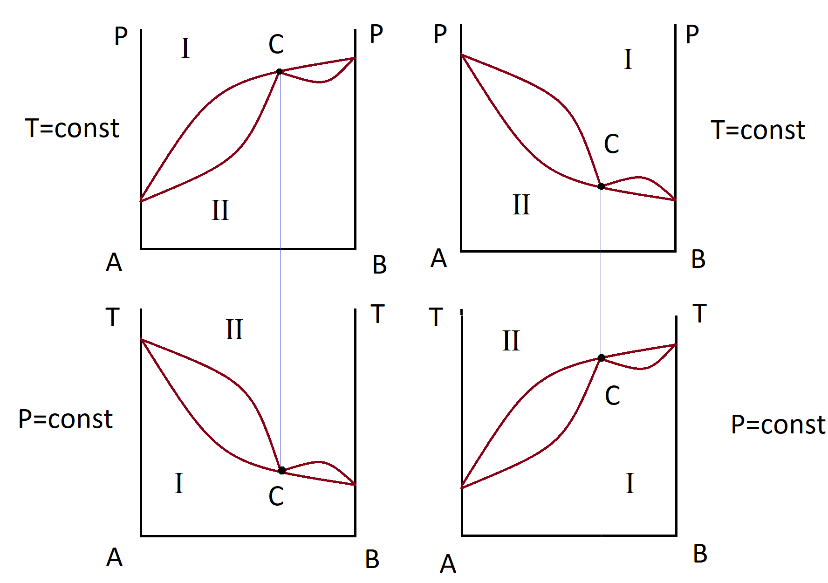 торой
закон Коновалова:
торой
закон Коновалова:
В том случае, когда система сильно отличается от идеальной, на диаграммах появляются точки экстремума.
Минимум на кривой р-состав, максимум на кривой т-состав говорит о том, что вещества образующие жидкий раствор склонны к ассоциации молекул. А максимум к диссоциации ассоциированных комплексов, что облегчает испарение и увеличивает давление пара.
Образование ассоциатов затрудняет испарение, понижая давление насыщенного пара.
Такие растворы называются азеотропными (кипящие без изменения состава)
20. Закон Генри. Растворимость газов в жидкостях
Закон Генри— закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон Генри записывается обычно следующим образом:
![]()
p— парциальное давление газа над раствором, Па
cмолярная концентрация газа в растворе, моль/л
k— коэффициент (константа) Генри, моль/(Па*л). Коэффициент зависит от природы газа и растворителя, а также от температуры.
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газообразного вещества, а смеси газов, то растворимость каждого компонента подчиняется закону Дальтона: растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов.
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты. Поэтому растворимость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономерность часто используют для удаления растворенных га–зов из воды (например СO2) кипячением. Иногда рас–творение газа сопровождается поглощением теплоты (например, растворение благородных газов в некоторых органических растворителях). В этом случае повышение температуры увеличивает растворимость газа.
Газ не растворяется в жидкости
беспредельно. При некоторой концентрации
газа X устанавливается равновесие:
![]()
При растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому повышение давления согласно принципу Ле Шателье должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малорастворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.): количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
