
РЕАКЦИИ ПО ГЕТЕРОЦИКЛИЧЕСКИМ
.pdf
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
•РЕАКЦИИ ПО ГЕТЕРОЦИКЛИЧЕСКИМ ОСНОВАНИЯМ
•Обсудим реакционную способность различных функциональных групп и центров в гетероциклических основаниях. А для этого мы должны вспомнить материал из прошлой жизни.
1
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
АТОМ
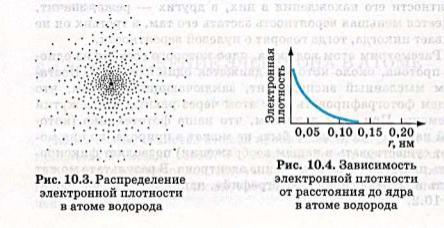
•Атом – это сложная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в электрическом поле ядра. Объединяют всю систему силы электростатического взаимодействия разноименных (ядерноэлектронное притяжение) и одноименных (межэлектронное отталкивание) электрических зарядов.
2
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В АТОМЕ ВОДОРОДА
3
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
ДВИЖЕНИЕ ЭЛЕКТРОНА В АТОМЕ
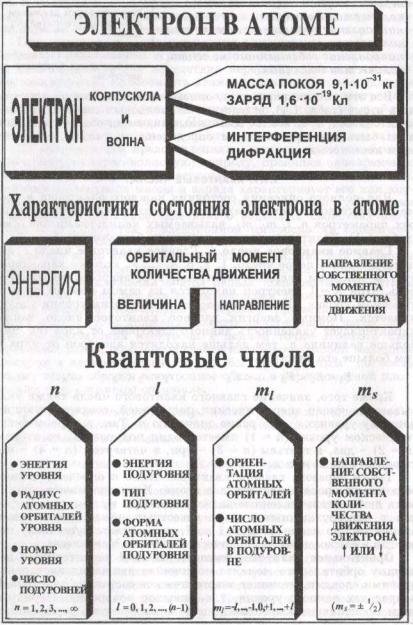
•Параметры для описания состояния электрона в атоме: энергия электрона, величина орбитального момента количества движения, направление орбитального момента количества движения, направление собственного момента количества движения.
•Все эти четыре параметра, описывающие состояние электрона в атоме, вследствие его волновых свойств должны квантоваться, т.е. все их возможные значения обязательно должны быть пропорциональны определенным числам, называемым квантовыми.
4
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
5

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
КВАНТОВЫЕ ЧИСЛА И ОРБИТАЛИ
•В квантовомеханической модели вводится три
квантовых числа (n, l, ml), позволяющие описать орбитали.
•1. Главное квантовое число (n) связано со средним расстоянием электрона от ядра, т.е. характеризует удаленность данного электрона от ядра (r). В основном характеризует энергию электрона, т.е. энергетический уровень. Может принимать целочисленные значения 1,2,3 и так далее. Чем больше величина n, тем дальше находится электрон от ядра и тем больше его энергия. Значение главного квантового числа указывает также на число энергетических подуровней, соответствующих данному уровню.
6

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
КВАНТОВЫЕ ЧИСЛА
•2. Орбитальное квантовое число (l) характеризует величину орбитального момента количества движения электрона, т.е. уточняет энергетическое состояние электронов в пределах данного уровня (энергию подуровня). Оно определяет пространственную форму атомных орбиталей электрона. Может принимать целочисленные значения от 0 до n – 1. Различные значения числа l принято обозначать латинскими буквами.
• |
0 |
1 |
2 |
3 |
4 |
• |
s |
p |
d |
f |
g |
7

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
КВАНТОВЫЕ ЧИСЛА
•3. Магнитное (азимутальное) квантовое число ml
•Определяет ориентацию атомных орбиталей в магнитном поле атома, а также число атомных орбиталей на энергетическом подуровне.
•Принимает целочисленные значения от –l до +l, включая и нуль, т.е. всего 2l + 1 значений, которым отвечает число атомных орбиталей в данном подуровне. Так, любой s-подуровень, где l = 0, ml = 0, содержит одну s-орбиталь;
•p-подуровень, где l = 1, ml = -1, 0, +1 – три орбитали, ориентированные по координатным осям x, y, z;
•d-подуровень, где l =2, ml = -2, -1, 0, +1, +2 – пять d-орбиталей, симметрично ориентированных в пространстве.
8

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
КВАНТОВЫЕ ЧИСЛА
•Спиновое квантовое число ms.
•Число ms характеризует собственный момент количества движения электрона, получивший название спин, и принимает два значения +1/2 - 1/2. Поскольку спин может иметь два
противоположных направления, его часто обозначают или . Электроны, находящиеся на
одной орбитали и обладающие противоположно направленными спинами , называются
спаренными, а одиночный электрон на орбитали называется неспаренным.
9
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
•Число электронов в атоме химического элемента определяется зарядом ядра, который равен порядковому номеру этого элемента в периодической системе Менделеева.
•Конкретное распределение электронов по орбиталям атома называется его электронной конфигурацией.
•Распределение электронов в атомах подчиняется трем основным принципам: принципу минимума энергии (правило В.М. Клечковского), принципу Паули и правилу Гунда.
10
