
3874
.pdf
31
ность измерений h1сл = (h1max −h1min ) |
2. В качестве погрешности h1 выбе- |
рите наибольшую из них. Погрешность |
h2 определяется аналогично. |
Окончательный результат измерения отношения теплоемкостей запишите |
|
в виде доверительного интервала |
|
γ = γэксп |
± γ . |
9. Воздух – это смесь в основном трех газов: азота N2 (78 % по объему),
кислорода O2 (21 %) и углекислого газа CO2 (0,03 %), молекулы которых имеют одинаковое число степеней свободы i = 5 (смотрите с. 25). Учитывая это, по формуле (7) рассчитайте теоретическое значение γтеор.
10. Сделайте вывод о совпадении теории с экспериментом, сопоставив теоретическое значение отношения теплоемкостей γ теор и экспериментальный
доверительный интервал γ = γэксп
γэксп  ± γ .
± γ .
11. Рассчитайте, насколько уменьшается температура воздуха в баллоне в результате адиабатического расширения. Это можно сделать двумя способами, рассматривая адиабатический процесс 1 → 2 или изохорический процесс 2 → 3 (рис. 2). В первом случае необходимо использовать связь давления и темпера-
туры для адиабатического процесса: T р(1−γ ) γ =T |
2 |
р(1−γ ) γ . Во втором случае – |
|||||||||||||||||||
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
2 |
|
|
||||||
уравнение изохорического процесса: |
р2 |
T2 = р3 |
T3 . Записывая параметры |
||||||||||||||||||
данных равенств согласно рис. 2, получаем для адиабатического процесса |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ −1 |
|
||
|
|
|
|
|
|
|
|
|
|
|
р |
атм |
|
|
γ |
|
|
||||
|
|
|
|
|
|
|
|
||||||||||||||
|
T |
|
=Tкомн 1 − |
|
|
|
|
|
|
|
|
|
, |
(15) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
ратм + ρgh1 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
для изохорического процесса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ратм |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
T |
|
=Tкомн 1 − |
|
|
|
|
|
|
|
|
|
|
. |
|
(16) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
ратм + ρgh2 |
|
|
||||||||||
(Способ расчета изменения температуры |
|
|
T |
|
указывает преподаватель). |
|
|||||||||||||||
|
|
|
|||||||||||||||||||
Комнатную температуру измерьте с помощью термометра в лаборатории и переведите полученный результат в абсолютную температуру. Атмосферное
давление примите равным ратм =105 Па. Плотность манометрической жидкости (воды) ρ =1000 кг/м3; g =9,8 м/с2. В качестве величин h1 и h2 (в метрах) используйте результаты измерения, например, первого опыта. Значение γ примите равным экспериментальному значению  γэксп
γэксп 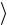 .
.
32
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Сформулируйте первый закон термодинамики.
2.Что такое: a) теплоемкость тела; б) удельная теплоемкость; в) молярная теплоемкость?
3.Что такое: a) теплоемкость при постоянном объеме; б) теплоемкость при постоянном давлении? Какая из них больше и почему?
4.Что такое число степеней свободы молекулы? Чему равно число степеней свободы для молекул азота N2 , кислорода O2 , углекислого газа CO2 ?
5.Что такое адиабатический процесс? Почему в данной работе процесс расширения газа при открывании крана можно считать адиабатическим?
6.Как и почему меняется температура газа при адиабатическом расшире-
нии?
7.Чему равен показатель адиабаты γ в уравнении Пуассона (6)?
8.Поясните, что характеризует объем V1 на рисунках 2 и 3.
9.Поясните причину повышения давления в баллоне сразу после адиабатического расширения газа и закрывания крана.
Библиографический список
1. Трофимова Т.И. Курс физики. 2000. §§ 42, 50–55.

33
Лабораторная работа № 3.6 (74)
ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ ПРИ ПЛАВЛЕНИИ ТВЕРДОГО ТЕЛА
Цель работы: изучение законов термодинамики, определение изменения энтропии при плавлении металлического образца.
ТЕОРЕТИЧЕСКИЙ МИНИМУМ
Энтропия
Энтропия S – функция, характеризующая состояние термодинамической системы (газа, жидкости, твердого тела) с точки зрения ее неупорядоченности. При любом бесконечно малом изменении состояния системы приращение dS удовлетворяет условию
dS ≥ |
δQ |
, |
(1) |
|
T |
||||
|
|
|
где δQ – количество тепла, полученное системой, Т – абсолютная температура, при которой система получила δQ. Знак неравенства описывает поведение S при необратимых, а знак равенства – при обратимых процессах. Для адиабатически изолированной системы (δQ = 0), как следует из (1),
dS ≥ 0 , |
(2) |
то есть энтропия теплоизолированной системы не может уменьшаться.
Поскольку все реальные тепловые процессы необратимы, переход любой замкнутой системы в состояние термодинамического равновесия сопровождается возрастанием S. Говоря другими словами, состояние равновесия в системе есть состояние с максимальной энтропией.
Необратимость процессов природы объясняется тем, что всякий подобный процесс представляет собой переход от менее вероятного состояния к более вероятному. Неупорядоченное тепловое движение оказывается самым вероятным, поскольку может быть осуществлено наибольшим числом способов и характеризуется поэтому максимальным значением термодинамической вероятности состояния W 1. Учитывая, что в изолированной системе
1 Термодинамическая вероятность (статистический вес) состояния определяется статистической суммой числа возможных равновероятных распределений, отвечающих данному макроскопическому состоянию системы.
34
протекают лишь такие процессы, при которых энтропия возрастает, нетрудно убедиться, что с возрастанием вероятности увеличивается и энтропия:
S =k lnW , |
(3) |
где k =1,38 10−23 Дж/К – постоянная Больцмана.
Законы (начала) термодинамики
Первый закон термодинамики: внутреннюю энергию U термодинамической системы можно увеличить двумя способами: произведя работу δA = −p dV над ней внешними силами (сжать), или сообщить системе некоторое количество теплоты δQ , то есть.
dU =δQ +δA . |
(4) |
Здесь р – давление в системе, dV – изменение объема системы.
Второй закон термодинамики: в замкнутой (термодинамически изолированной) системе наиболее вероятными являются процессы, сопровождающиеся возрастанием энтропии. Эта формулировка непосредственно следует из соотношения (3).
МЕТОДИКА ЭКСПЕРИМЕНТА
В работе определяется изменение энтропии S при нагревании и плавлении металлического образца (олово, индий, кадмий, свинец или др.).
Нагрев и плавление образца осуществляется на установке, схема которой приведена на рис. 1. На замкнутый железный сердечник 1, набранный из тонких электрически изолированных друг от друга пластин, надеты катушка индуктивности 2 и керамическое кольцо 3, в углублении которого размещается исследуемый образец 4 в виде замкнутого витка. На катушку индуктивности подается переменное напряжение, регулируемое автотрансформатором 5. При протекании по катушке индуктивности переменного тока в образце возникает индукционный ток и выделяется джоулево тепло, за счет которого происходит разогрев образца. Непосредственно в образце находится спай термопары 6, которая подключена к милливольтметру 7.
Температура образца определяется по измеренным значениям термоЭДС Е и градуировочной таблице термопары. Значения термо-ЭДС, приведенные в этой таблице, измерены для случая, когда температура «холодного спая» термопары равна 0˚С. В наших условиях величина Е измеряется отно-
35
сительно комнатной температуры tк . Поэтому абсолютная температура об-
разца |
|
Т = (t −tк + 273) К, |
(5) |
где tк – комнатная температура; температура t |
определяется по градуиро- |
вочной таблице с использованием измеренных значений термо-ЭДС Е.
Расчет изменения энтропии S производится следующим образом. Считая процессы нагревания и плавления обратимыми, с учетом соотношения (1) найдем
S2 |
Tпл |
δQ |
|
жидк. δQ |
|
Tmax δQ |
|
|
|
|
||||
∫dS = |
∫ |
|
+ |
∫ |
|
|
|
+ ∫ |
|
|
, |
или |
|
|
T |
|
T |
T |
|
|
|
||||||||
S |
Tк |
|
тв. |
|
Tпл |
|
|
|
|
|
||||
|
|
пл |
|
|
|
|
|
|
|
|||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tпл |
δQ |
|
1 |
|
жидк. |
|
Тmax δQ |
|
|
|||
S =S2 −S1 = |
∫ |
|
+ |
|
|
∫δQ + |
|
∫ |
|
, |
(6) |
|||
T |
Тпл |
|
|
T |
||||||||||
|
|
T |
|
|
тв. |
|
|
T |
|
|
||||
|
|
|
к |
|
|
|
|
|
|
|
пл |
|
|
|
где первое слагаемое в правой части представляет собой изменение энтропии образца, вызванное его нагревом от комнатной температуры Тк до температуры плавления Тпл , второе – изменение энтропии при плавлении образца, а третье – изменение энтропии при нагревании жидкой фазы образца от Тпл до Ттах . Во втором слагаемом температура Тпл вынесена за знак интеграла, поскольку при неизменном давлении плавление происходит при постоянной

|
|
36 |
|
|
температуре. Учитывая, |
что в первом слагаемом δQ =c1 m dT |
(где c1 – |
||
удельная |
теплоемкость |
твердого образца, m – |
его масса), во втором |
|
Q =qплm |
(qпл – удельная теплота плавления |
образца), а в |
третьем |
|
δQ =c2 m dT (c2 – удельная теплоемкость жидкой фазы образца), окончательно получим
S =c m ln Tпл + qплm |
+с m ln Tmax . |
(7) |
|||
1 |
Тк |
Tпл |
2 |
Tпл |
|
|
|
|
|||
Приборы и принадлежности: установка с катушкой индуктивности, керамическим кольцом и образцом; автотрансформатор; термопара; милливольтметр; секундомер.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1.В соответствии с индивидуальным заданием или по указанию преподавателя выберите исследуемый образец, напряжение на катушке индуктивности и максимальное значение термо-ЭДС.
2.Включите установку в сеть. Затем замкните ключ К1 и убедитесь,
что цифровой вольтметр находится в положении «мВ» (светится лампочка справа). На табло должны быть нулевые показания.
3.Замкните ключ К2 и рукояткой автотрансформатора введите
нужное значение напряжения.
4. Сразу после включения ключа К2 через каждые примерно 10 с по милливольтметру определяйте величину термо-ЭДС Е. Время τ и значения Е заносите в табл. 1.
Таблица 1
τ, с |
Е, мВ |
t, °C |
(t – tк), °C |
T, К |
|
|
|
|
|
|
|
|
|
|
5. Измерения значений Е проводите до тех пор, пока не будет получено максимальное значение Етах. Затем ручкой автотрансформатора уменьшите напряжение до нуля и выключите ключи К1 и К2 и установку из сети.
37
6.Используя измеренные значения Е и градировочную таблицу термопары (см. Приложение), определите температуру t для каждого измерения и занесите ее в табл. 1.
7.По лабораторному термометру определите комнатную температуру tк , после чего по формуле (5) вычислите абсолютную температуру Т
образца для каждого момента времени τ . Результаты занесите в табл. 1.
8.Постройте график зависимости температуры образца Т от времени τ . Учитывая, что при плавлении температура образца не изменяется, по графику Т (τ ) определите температуру плавления Тпл .
9.Используя формулу (7), определите изменение энтропии на от-
дельных этапах: нагревание от Тк до Тпл , плавление, нагрев от Тпл до Тmax , а также за весь процесс нагревания образца от Тк до Тmax .
Масса образца т указана на установке.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1Поясните смысл функции энтропии.
2Как Вы считаете, будет ли изменяться энтропия, если в термодинамической системе изменяется а) только температура; б) только объем? Если да, то каким образом? Если нет, то почему?
3Обратимыми или необратимыми являются реально протекающие тепловые процессы? Почему?
4Учитывая, что вероятность сложного события равна произведению вероятностей простых событий, покажите, не используя математических выкладок, что энтропия должна быть пропорциональна натуральному логарифму термодинамической вероятности W.
5Поясните, изменится ли ход выполнения работы, если вместо переменного источника напряжения к катушке индуктивности подключить источник постоянного напряжения.
6Можно ли сердечник катушки индуктивности в данной работе сделать из сплошного материала? Если да, то из какого? Если нет, то почему?
Библиографический список
Трофимова Т.И. Курс физики. 2000. § 59.

|
38 |
|
|
|
ПРИЛОЖЕНИЕ |
|
|
НЕКОТОРЫЕ ФИЗИЧЕСКИЕ ПОСТОЯННЫЕ |
|||
Универсальная газовая постоянная |
R = 8,31 Дж/(моль К) |
||
Число Авогадро |
|
N A = 6,022 10 23 моль–1 |
|
Постоянная Больцмана |
|
k = 1,38 10 –23 Дж/К |
|
Число Лошмидта |
|
n0 |
= 2,69 10 25 м –3 |
Ускорение свободного падения (стандартное) |
g = 9,81 м/с2 |
||
ДЕСЯТИЧНЫЕ ПРИСТАВКИ К НАЗВАНИЯМ ЕДИНИЦ |
|||
Г – гига (10 9) |
д – деци (10 – 1) |
мк – микро (10 – 6) |
|
М – мега (10 6) |
с – санти (10 – 2) |
н – нано (10 – 9) |
|
к – кило (10 3) |
м – милли (10 – 3) |
п – пико (10 – 12) |
|
Например: 1 кДж = 10 3 Дж; 1 мкН = 10 – 6 |
Н; 1 нм = 10 – 9 м |
||
НЕКОТОРЫЕ СПРАВОЧНЫЕ ДАННЫЕ ДЛЯ ВОЗДУХА |
|||
Молярная масса |
|
М = 2,9 10−3 кг/моль |
|
Эффективный диаметр молекулы |
|
d = 2,7 10−10 м |
|
Плотность (при нормальных условиях) |
|
ρ =1,29 кг/м3 |
|
Длина свободного пробега |
(при нормальных условиях) |
l =1,16 10−7 м |
|
Коэффициент вязкости (при T =300К) |
|
η = 2,34 10−5 Па с |
|
(Нормальные условия: давление р =105 Па; температура Т = 273К) |
|||
Удельные теплоемкости твердого С1 и жидкого С2 состояний и удельная теплота плавления ( λ ) некоторых веществ
Вещество |
Sn |
In |
Cd |
Pb |
Bi |
|
230 |
238 |
230 |
134 |
133 |
C1, Дж/(кг К) |
|
|
|
|
|
|
|
|
|
166 |
|
|
247 |
259 |
264 |
287 |
|
C2 , Дж/(кг К) |
|
|
|
|
|
|
|
|
|
24,6 |
|
λ, кДж/кг |
58,6 |
28,4 |
55,2 |
54,3 |
|
|
|
|
|
|
|
39
ГРАДУИРОВОЧНАЯ ТАБЛИЦА ТЕРМОПАРЫ
|
|
|
|
|
|
Е, мВ |
t, °С |
Е, мВ |
t, °С |
Е, мВ |
t, °С |
0 |
0 |
9,55 |
135 |
20,43 |
270 |
0,35 |
5 |
9,93 |
140 |
20,84 |
275 |
0,65 |
10 |
10,31 |
145 |
21,25 |
280 |
0,98 |
15 |
10,69 |
150 |
21,66 |
285 |
1,33 |
20 |
11,08 |
155 |
22,08 |
290 |
1,64 |
25 |
11,45 |
160 |
22,49 |
295 |
1,98 |
30 |
11,85 |
165 |
22,91 |
300 |
2,32 |
35 |
12,24 |
170 |
23,33 |
305 |
2,66 |
40 |
12,63 |
175 |
23,75 |
310 |
3,00 |
45 |
13,03 |
180 |
24,18 |
315 |
3,35 |
50 |
13,44 |
185 |
24,60 |
320 |
3,70 |
55 |
13,84 |
190 |
25,03 |
325 |
4,05 |
60 |
14,25 |
195 |
25,45 |
330 |
4,41 |
65 |
14,66 |
200 |
25,85 |
335 |
4,76 |
70 |
15,06 |
205 |
26,32 |
340 |
5,12 |
75 |
15,48 |
210 |
26,74 |
345 |
5,48 |
80 |
15,89 |
215 |
27,16 |
350 |
5,85 |
85 |
16,30 |
220 |
27,59 |
355 |
6,21 |
90 |
16,71 |
225 |
28,02 |
360 |
6,58 |
95 |
17,12 |
230 |
28,46 |
365 |
6,95 |
100 |
17,53 |
235 |
28,89 |
370 |
7,32 |
105 |
17,95 |
240 |
29,33 |
375 |
7,69 |
110 |
18,36 |
245 |
29,76 |
380 |
8,06 |
115 |
18,77 |
250 |
30,18 |
385 |
8,43 |
120 |
19,18 |
255 |
30,62 |
390 |
8,80 |
125 |
19,60 |
260 |
31,06 |
395 |
9,18 |
130 |
20,01 |
265 |
31,49 |
400 |
40
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1Трофимова, Т.И. Курс физики [Текст]: учеб. пособие / Т.И. Трофимова.
– 6-е издание. – М.: Высш. шк. 2000.– 542 с.
2Курс физики [Текст] / под ред. В.Н. Лозовского.– 2-е изд., испр.– СПб.:
Лань, 2001. – Т.1.– 576 с.
3Дмитриева, В.Ф. Основы физики [Текст]: Учеб. пособие / В.Ф. Дмитриева, В.Л. Прокофьев. – М.: Высш. шк. 2001.– 527 с.
4Грибов, Л.А. Основы физики [Текст] / Л.А. Грибов, Н.И. Прокофьва.–
М.: Гароарика, 1998.– 456 с.
5Основы физики В 2-х т. [Текст]: Учеб. для вузов / Н.П. Калашников, М.А. Смондырев. – 2-е изд., перераб. – М.: Дрофа, 2004. – Т. 2.– 432 с.
