
808
.pdfже серной кислоты H2SO4 и несколько капель перекиси водорода H2O2 . Образование свободного йода проверьте реакцией с крахмалом. Отметьте, что перекись водорода H2O2 в одной реакции является окислителем, а в другой – восстановителем. Напишите уравнения и расставьте коэффициенты.
Опыт 3. Реакция диспропорционирования.
В пробирку налейте 1 мл раствора нитрита калия KNO2, добавьте несколько капель 2 N раствора серной кислоты H2SO4 . Наблюдайте выделение бурого газа диоксида азота NO2. Напишите уравнение взаимодействия нитрита калия KNO2 с серной кислотой H2SO4 и разложения образовавшейся нестойкой азотистой кислоты НNO2 с выделением оксидов азота NO и NO2 . Какая из реакций является окисли- тельно-восстановительной? Укажите окислитель и восстановитель.
Опыт 4. Типы окислительно-восстановительных реакций.
а). Реакции по типу О+В+С. К 1 мл раствора перманганата калия КМnО4 прибавьте равный объем 2 N раствора серной кислоты H2SO4 и немного свежеприготовленного раствора сульфата двухвалентного железа FeSO4 или нитрита натрия NaNO2. В другую пробирку налейте немного раствора бихромата калия K2CrO4, добавьте столько же раствора серной кислоты Н2SO4 и немного раствора иодида калия KI. Объясните изменение цвета раствора в обеих пробирках. Выпишите уравнения реакций, расставьте коэффициенты и укажите окислитель, восстановитель и среду раствора.
б). Реакции по типу В+С/О (опыт проводите под тягой). В пробирку налейте немного разбавленной азотной кислоты HNO3 и бросьте медную стружку. Наблюдайте выделения окиси азота NO, которая на воздухе переходит в бурый газ NO2. Как изменилась окраска раствора? Напишите уравнение реакции, расставьте коэффициенты, укажите окислитель и восстановитель.
в). Реакции по типу О+В/С (опыт проводите под тягой). В сухие пробирки поместите отдельно небольшое количество кристаллов перманганата калия KMnO4 и бихромата калия K2Сr2O7 . В обе пробирки добавьте нескольку капель концентрированной соляной кислоты НCl. Наблюдайте образования газообразного хлора Сl2 (желто-зеленого цвета). Пробирки с содержимым оставить под тягой. Напишите уравнение реакции, расставьте коэффициенты и укажите окислители и восстановители.
31
Вопросы для самоконтроля
1. Указать, какие из перечисленных веществ могут быть только окислителями, окислителями и восстановителями? Cl2, Cu0, HCl, HClO4, Cr2O3, ZnS, KBr, H3PO4, H2SO4, Ag0, FeCl3, Cu(OH)2, K2CrO4, KMnO4.
2.Привести примеры реакций, в которых водород H2 является окислителем, и тех, где H2 является восстановителем.
3.Какие из указанных реакций соединения являются окислительновосстановительными? Написать уравнения, расставить коэффициенты:
CaO + CO2 →
Fe + Cl2 →
Zn + S →
Mg + O2 →
MgO + SO3 →
4. Закончить уравнения, расставить коэффициенты, указать окислитель и восстановитель:
KMnO4 + K2SO3 + H2SO4 →
KMnO4 + FeSO4 + H2SO4 →
K2CrO4 + Na2SO3 + H2SO4 → K2Cr2O7 + HCl →
K2Cr2O7 + H2S + H2SO4 →
K2CrO4 + FeCl2 + HCl →
5. Написать уравнение окислительно-восстановительной реакции в кислой, щелочной и нейтральных средах, расставить коэффициенты:
KMnO4 + SnCl2 + HCl →
K2CrO4 + KI + HCl →
Cr(OH)3 + Br2 + KOH →
AgNO3 + H2O2 + NH4OH → Na2SO3 + I2 + H2O →
P + HNO3 + H2O →
6. Закончить уравнение окислительно-восстановительной реакции, расставить коэффициенты:
СuS + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O. KClO3 + HCl → KCl + Cl2 + H2O.
NH3 + O2 → NO + H2O.
Zn + H2SO4 → ZnSO4 + SO2 + H2O.
PbS +HNO3 → Pb (NO3)2 + H2SO4 + NO + H2O.
32
Тест для подготовки к экзамену
1. Какие из реакций, протекающих по схемам
1.K2Cr2O7 + H2SO4 → CrO3 + K2SO4 + H2O;
2.KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O;
3.Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH,
являются окислительно-восстановительными?
1)1 и 2;
2)2 и 3;
3)1 и 3;
4)3.
2.Окислители – это вещества,
1)принимающие электроны;
2)отдающие электроны;
3)возводящие в квадрат электроны.
3.Определите степень окисления хрома в соединении K2Cr2O7.
1)+3;
2)+6;
3)-6;
4)0.
4.В какой группе периодической системы Д.И. Менделеева находятся самые сильные окислители?
1)III;
2)IV;
3)VI;
4)VII.
5.MnO2 в окислительно-восстановительных реакциях может быть
1)только окислителем;
2)только восстановителем;
3)и окислителем и восстановителем.
6.Азот в соединениях проявляет разные степени окисления: NH3; N2; NO; NO2; KNO3. Минимальная степень окисления азота равна
1)-1;
2)-2;
33

3)-3;
4)+5.
7.Атомы металлов являются
1)восстановителями;
2)окислителями;
3)не меняют степень окисления.
8.Для окислительно-восстановительной реакции
Mg + H2SO4 К → MgSO4 + H2S + H2O определите: какое число молей атомов кислорода в левой или в правой части уравнения?
1)18;
2)20;
3)22;
4)28.
9.Для окислительно-восстановительной реакции
AsH3 + AgNO3 + H2O → Ag + H3AsO4 + HNO3 определите: сколько молей восстановителя участвует в реакции.
1)4;
2)3;
3)2;
4)1.
10.Окислительно-восстановительная реакция может протекать в прямом направлении согласно второму закону термодинамики, если
1) ∆G < 0;
2)∆G > 0;
3)∆G = 0;
4)
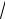 ΔG .
ΔG .
11.Для окислительно-восстановительной реакции
PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O определите:
сколько молей воды участвует в реакции.
1)10;
2)12;
3)13;
4)14.
34
12. Определите тип окислительно-восстановительной реакции
Al + 4HNO3 разб.→ Al(NO3)3 + NO + 2H2O.
1)О + В;
2)В+О/среда;
3)В/среда + О;
4)О + В + среда.
13.Для окислительно-восстановительной реакции
KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O определите:
сколько молей окислителя участвует в реакции.
1)1;
2)2;
3)3;
4)4.
14.Перекись водорода в окислительно-восстановительных реакциях может быть
1)только окислителем;
2)только восстановителем;
3)проявляет окислительно-восстановительную двойственность.
15.Для окислительно-восстановительной реакции
H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O определите:
сколько молей воды участвует в реакции.
1)3;
2)5;
3)7;
4)9.
16.Для окислительно-восстановительной реакции
KIO3 + Na2SO3 + H2SO4 → I2 + Na2SO4 + K2SO4 + H2O определите:
сколько молей окислителя участвует в реакции.
1)2;
2)3;
3)4;
4)5.
17.Для окислительно-восстановительной реакции
35
KMnO4 + NaNO2 + H2O→MnO2 + NaNO3 + KOHопределитетип реакций.
1)О + В + среда (кислая);
2)О + В + среда (щелочная);
3)О + В + среда (нейтральная).
18.Что можно считать правой частью уравнения реакции
Na2Cr2O7 + FeSO4 + H2SO4→?
1)NaCrO2 + Fe(ОН)3 + Na2SO4 + H2О;
2)Cr2(SO4)3 + Fe2(SO4)3 + Na2SO4 + H2О;
3)Cr(ОН)3 + Fe(ОН)3 + Na2SO4 + H2О;
4)Cr2(SO4)3 + Fe(ОН)3 + Na2SO4 + H2О.
19.Какие два вещества одновременно образуются в реакции
PbO2 + HBr→?
1)Pb(OН)4; Br2;
2)PbBr2; Br2;
3)PbO; PbBr2;
4)Pb(OН)2; Br2.
20.Какие два вещества одновременно образуются в реакции
Zn + KOH→?
1)Zn(ОН)2; H2О;
2)ZnО; KH;
3)K2ZnO2; H2О;
4)K2ZnO2; H2.
21.Какое вещество может быть использовано в качестве окислителя в химических реакциях?
1)Br2;
2)K;
3)Са;
4)Al.
22.Сколько молей хлора вступает в реакцию с 2 молями йода
I2 +Cl2 + H2О→ HIO3 + HCl ?
1)10;
2)2;
3)8;
4)9.
36
23. Что следует написать в качестве конечных продуктов реакции
CrO3 + HBr→?
1)Cr(ОН)3 + Br2 + H2О;
2)CrBr3 + H2 + H2О;
3)H2CrO4 + Br2 + H2О;
4)CrBr 3+ Br2 + H2О.
24.Чему равна сумма коэффициентов перед исходными веществами уравнения реакции Na2Cr2O7 + NaNO2 + H2SO4→?
1)5;
2)9;
3)8;
4)13.
25.Что является продуктом реакции MnO2 + FeSO4 + H2SO4→?
1)Fe(ОН)3;
2)Fe(ОН)2;
3)Fe2(SO4)3;
4)Fe.
Ответы на тест:
Номер |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
вопроса |
|
|
|
|
|
|
|
|
|
|
|
Вариант |
2 |
1 |
2 |
4 |
3 |
3 |
1 |
2 |
4 |
1 |
2 |
ответа |
|
|
|
|
|
|
|
|
|
|
|
Номер |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
вопроса |
|
|
|
|
|
|
|
|
|
|
|
Вариант |
2 |
2 |
3 |
3 |
1 |
3 |
2 |
2 |
4 |
1 |
1 |
ответа |
|
|
|
|
|
|
|
|
|
|
|
Номер |
23 |
24 |
25 |
|
|
|
|
|
|
|
|
вопроса |
|
|
|
|
|
|
|
|
|
|
|
Вариант |
4 |
3 |
3 |
|
|
|
|
|
|
|
|
ответа |
|
|
|
|
|
|
|
|
|
|
|
37
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
(Время на самостоятельную работу – 16 часов)
Химические реакции, сопровождающиеся возникновением электрического тока или протекающие под действием электрического то-
ка, называются электрохимическими.
Гальванические элементы
Гальваническими элементами называются устройства, которые применяют для превращения энергии окислительно-восстанови- тельной реакции в электрическую энергию. В простейшем случае гальванический элемент состоит из двух электродов – пластин или стержней, изготовленных из разных металлов и погруженных в раствор электролита. В такой системе окислительно-восстановительные реакции пространственно разделены: окисление протекает на одном металле, а восстановление – на другом. Электроны передаются от восстановителя к окислителю по внешней цепи. Этот направленный поток электронов представляет собой электрический ток. Важным понятием в гальваническом элементе является электродный потенциал.
В кристаллической решетке металла существует подвижное равновесие, которое выражается уравнением Ме ↔ Ме+n + ne- . При погружении металла в водный раствор ионы металла под действием полярных молекул воды отрываются и переходят в раствор. При этом металлическая пластина заряжается отрицательно, а раствор положительно. Возникает двойной электрический слой. Между пластинкой и прилегающим к ней слоем раствора возникает скачок потенциалов. Возникшая разность электростатических потенциалов на границе между металлом (электродом) и раствором есть электродный потен-
циал.
При погружении металлического электрода в раствор одноименной соли в зависимости от природы металла возможен переход ме-
талла в состояние иона – процесс окисления: |
|
|
Ме0 ↔ |
Ме+n + |
ne- |
или обратный процесс – восстановления: |
|
|
Ме+n + |
ne- ↔ |
Ме0. |
Принято считать скачок потенциала положительным, если металл заряжен положительно относительно двойного электрического слоя, и
38
отрицательным, если металл заряжен отрицательно. Для каждого металлического электрода величину его электродного потенциала измеряют относительно электрода сравнения, потенциал которого условно принят равным нулю (водородный электрод).
Вследствие различной химической активности металлов их электродные потенциалы различаются. Если металлы расположить по мере возрастания их электродных потенциалов, то получится ряд, называемый электрохимическим (см. приложение).
Na+ Mg+2 |
Zn+2 |
Fe+2 |
Ni+2 |
Pb+2 |
Н+ |
Си+2 |
Аg+ Рt+2 |
Аu+3 |
-2,71 -2,36 |
-0,76 |
-0,44 |
-0,23 |
-0,13 |
0 |
0,34 |
0,799 1,20 |
1,50 |
Ряд напряжений имеет не только большое теоретическое значение, но с его помощью можно решить ряд практических вопросов:
1. Металлы, стоящие в ряду до водорода , взаимодействуют с кислотами, вытесняя водород:
Zn + 2HCl ZnCl2 + H2↑.
2. Металлы, стоящие в ряду после водорода, характеризуются химической инертностью и не вытесняют водород из раствора кислот:
Ag + HCl .
3. Любой металл, стоящий левее (т.е. предыдущий), вытесняет из растворов солей металл, стоящий правее (т.е. последующий):
Fe + CuCl2 Сu0 + FeCl2.
4. В гальваническом элементе металл, стоящий левее (с меньшим потенциалом), будет анодом, а металл, стоящий правее, – катодом.
Металлы, более активные, чем водород, имеют отрицательный потенциал, а менее активные – положительный.
Электродный потенциал зависит от природы металла, концентрации в растворе его катионов, их валентности и температуры.
Для сравнения измеряют потенциалы электродов, опущенных в растворы с концентрацией ионов металла 1 моль/л и при температуре 25 ° С. Такой электродный потенциал называется стандартным и обозначается 0.
Зависимость электродного потенциала от концентрации ионов металла в растворе С и температуры Т описывается уравнением Нернста:
= 0 + RT/nF lnCMe+n ,
39
где 0 – стандартный электродный потенциал, В; С – концентрация ионов металла в растворе, моль/л; T – абсолютная температура раствора, Кельвин; n – заряд иона металла; F – число Фарадея (96495 Кл); R – универсальная газовая постоянная (8,314 Дж/моль).
Если подставить значения констант и перевести натуральный логарифм ln в десятичный lg, то уравнение Нернста примет следующий вид:
= 0 + 0,059/n lgCMe+n.
Основной количественной характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как разность электродных потенциалов катода и анода.
ЭДС = к а.
О возможности осуществления окислительно-восстановительной реакции в гальваническом элементе можно судить по изменению изо- барно-изотермического потенциала системы (кДж). Связь между ΔG и ЭДС выражается уравнением
∆G = - nFE,
где Е - ЭДС гальванического элемента.
Если известна константа равновесия реакции К, протекающей в гальваническом элементе, то ЭДС можно определить из следующей зависимости:
E = 0,059/n ln К.
Гальванический элемент Даниэля-Якоби
Рассмотрим принцип работы и окислительно-восстановительные реакции на примере медно-цинкового гальванического элемента (Да- ниэля-Якоби) (рис. 1).
Цинк, имеющий отрицательный электродный потенциал, выс-
тупает в качестве анода и будет окисляться: Zno - 2е- → Zn2+.
На медном катоде будут восстанавливаться ионы меди
Cu 2+ + 2e- → Cuo.
Суммарное уравнение реакции выглядит так: Zno + Cu 2+ → Zn2+ + Cuo.
Схема гальванического элемента:
(-) Zn | Zn SO4 | | Cu SO4 | Cu (+). За счет окислительно-
восстановительной реакции во внешней цепи течет электрический ток, который можно зафиксировать прибором, а по внутренней цепи
40
