
738
.pdf
В.П. Расщупкин, М.С. Корытов
ПРОИЗВОДСТВО СТАЛИ.
МЕТОДИКА ВЫПЛАВКИ
Федеральное агентство по образованию Сибирская государственная автомобильно-дорожная академия
(СибАДИ)
В.П. Расщупкин, М.С. Корытов
ПРОИЗВОДСТВО СТАЛИ.
МЕТОДИКА ВЫПЛАВКИ
Учебное пособие
Омск Издательство СибАДИ
2007
УДК 669.1 ББК 34.327 Р 24
Рецензенты:
канд. техн. наук, доц. В.И. Гурдин, канд. техн. наук, доц. В.И. Лиошенко
Работа одобрена редакционно-издательским советом академии в качестве учебного пособия по дисциплине «Технология конструкционных материалов» для студентов механических специальностей вузов.
Расщупкин В.П., Корытов М.С. Производство стали. Методика выплавки:
Учебное пособие. – Омск: Изд-во СибАДИ, 2007. – 39 с.
Изложены сведения о физико-химических основах производства стали, рассматриваются основные способы выплавки стали в современной металлургии: в кислородных конвертерах, в мартеновских печах, в электропечах, а также пути повышения качества стали.
Табл. 2. Ил. 8. Библиогр.: 3 назв.
В.П. Расщупкин, М.С. Корытов, 2007
3
ОГЛАВЛЕНИЕ
Введение.............................................................................................. |
4 |
1. Производство стали…………………………………………….. |
5 |
1.1. Шлаки сталеплавильных процессов……………………. |
5 |
1.2. Основные реакции сталеплавильных процессов……… |
6 |
1.2.1. Окисление углерода……………………………… |
6 |
1.2.2. Окисление и восстановление марганца………… |
6 |
1.2.3. Окисление и восстановление кремния…………. |
7 |
1.2.4. Окисление и восстановление фосфора…………. |
7 |
1.2.5. Десульфация стали……………………………….. |
7 |
1.2.6. Газы в стали………………………………………. |
8 |
1.2.7. Раскисление стали………………………………… |
9 |
2. Производство стали в конвертерах………………………….. |
10 |
2.1. Кислородно-конвертерный процесс |
|
сверхней продувкой…………………………………………. 10 2.2. Кислородно-конвертерный процесс
сдонной продувкой………………………………………….. 14 2.3. Конвертерный процесс с комбинированной продувкой…………………………………………………….. 15
3. Производство стали в мартеновских печах………………… |
16 |
4. Производство стали в электропечах………………………… |
17 |
4.1. Выплавка стали в кислых электродуговых печах…….. |
19 |
4.2. Способы интенсификации выплавки стали |
|
в большегрузных печах. Одношлаковый процесс…………. |
20 |
4.3. Плавка стали с рафинированием в ковше |
|
печным шлаком……………………………………………… |
20 |
4.4. Плавка стали в индукционной печи…………………… |
21 |
5. Разливка стали…………………………………………………. |
22 |
5.1. Разливка стали в слитки………………………………… |
22 |
6. Пути повышения качества стали……………………………. |
22 |
6.1. Обработка жидкого металла вне сталеплавильного |
|
агрегата……………………………………………………….. |
23 |
6.2. Производство стали в вакуумных печах……………… |
25 |
6.3. Производство стали в индукционных печах………….. |
26 |
6.4. Производство стали в вакуумных дуговых печах…….. |
27 |
6.5. Плазменно-дуговая плавка……………………………… |
29 |
Заключение…..................................................................................... |
30 |
Библиографический список…........................................................ |
31 |
Приложение………………………………………………………… |
32 |
4
ВВЕДЕНИЕ
Металлы относятся к числу наиболее распространенных материалов, которые человек использует для обеспечения своих жизненных потребностей. В наши дни трудно найти такую область производства, научно-технической деятельности человека или просто его быта, где металлы не играли бы главенствующей роли конструкционного материала.
Металлы разделяют на несколько групп: черные, цветные и благородные. К группе черных металлов относятся железо и его сплавы, марганец и хром, к цветным – почти все остальные металлы периодической системы Д. И. Менделеева.
Железо и его сплавы являются основой современной технологии
итехники. В ряду конструкционных металлов железо стоит на первом месте и не уступит его еще долгое время, несмотря на то, что цветные металлы, полимерные и керамические материалы находят все большее применение. Железо и его сплавы составляют более 90 % всех металлов, применяемых в современном производстве.
Самым важнейшим из сплавов железа является его сплав с углеродом. Углерод придает прочность сплавам железа. Эти сплавы образуют большую группу чугунов и сталей.
Сталями называют сплавы железа с углеродом, содержание которого не превышает 2,14 %. Сталь – важнейший конструкционный материал для машиностроения, транспорта и т. д.
Сталеплавильное производство – это получение стали из чугуна
истального лома в сталеплавильных агрегатах металлургических заводов. Сталеплавильное производство является вторым звеном в общем производственном цикле черной металлургии. В современной металлургии основные способы выплавки стали – кислородноконвертерный, мартеновский и электросталеплавильный процессы. Соотношение между этими видами сталеплавильного производства меняется [1, 2, 3].
Сталеплавильный процесс является окислительным процессом, так как сталь получается в результате окисления и удаления большей части примесей чугуна – углерода, кремния, марганца и фосфора. Отличительная особенность сталеплавильных процессов заключается в наличии окислительной атмосферы. Окисление примесей чугуна и других шихтовых материалов осуществляется кислородом, содержащимся в газах, оксидах железа и марганца. После окисления примесей из металлического сплава удаляют растворенный в нем кисло-
5
род, вводят легирующие элементы и получают сталь заданного химического состава.
1.ПРОИЗВОДСТВО СТАЛИ
1.1.Шлаки сталеплавильных процессов
Роль шлаков в процессе производства стали исключительно велика. Шлаковый режим, определяемый количеством и составами шлака, оказывает большое влияние на качество готовой стали, стойкость футеровки и производительность сталеплавильного агрегата. Шлак образуется в результате окисления составляющих части шихты, из оксидов футеровки печи, флюсов и руды. По свойствам шлакообразующие компоненты можно разделить на кислотные (SiO2, Р2O5, TiO2 и др.), основные (СаО, МgО, FeО, МnО и др.) и амфотерные (Аl2O3, Fe2O3, Сr2O3, V2O3 и др.) оксиды. Важнейшими компонентами шлака, оказывающими основное влияние на его свойства, являются оксиды SiО2 и СаО.
Шлак выполняет несколько важных функций в процессе выплавки стали:
1.Связывает все оксиды (кроме СО), образующиеся в процессе окисления примесей чугуна. Удаление таких примесей, как кремний, фосфор и сера, происходит только после их окисления и обязательного перехода в виде оксидов из металла в шлак. В связи с этим шлак должен быть надлежащим образом подготовлен для усвоения и удержания оксидов примесей.
2.Во многих сталеплавильных процессах служит передатчиком кислорода из печной атмосферы к жидкому металлу.
3.В мартеновских и дуговых сталеплавильных печах через шлак происходит передача тепла металлу.
4.Защищает металл от насыщения газами, содержащимися в атмосфере печи.
Изменяя состав шлака, можно отчищать металл от таких вредных примесей, как фосфор и сера, а также регулировать по ходу плавки содержание в металле марганца, хрома и некоторых других элементов.
Для того чтобы шлак мог успешно выполнять свои функции, он должен в различные периоды сталеплавильного процесса иметь определенный химический состав и необходимую текучесть (величина,

6
обратная вязкости). Эти условия достигаются использованием в качестве шихтовых материалов плавки расчетных количеств шлакообразующих – известняка, извести, плавикового шпата, боксита и др.
1.2. Основные реакции сталеплавильных процессов
Сталь получают из чугуна и лома методом окислительного рафинирования (т. е. очищения). Кислород для окисления содержащихся в них примесей (углерода, марганца, кремния, фосфора и др.) поступает либо из атмосферы, либо из железной руды или других окислителей, либо при продувке ванны газообразным углеродом.
1.2.1. Окисление углерода
Особенность окисления углерода заключается в том, что продуктом этой реакции является газообразный СО, который, выделяясь из металлической ванны в виде пузырей, создает впечатление кипящей жидкости. Реакцию окисления углерода, растворенного в металле можно написать в следующем виде:
[С]+[O]={СO}; К= pco ,
C O
где [С]; [O] – концентрации растворенных в металле углерода и кислорода.
1.2.2. Окисление и восстановление марганца
Марганец как элемент, обладающий высоким сродством к кислороду, легко окисляется как при кислом, так и при основном процессах. Реакции окисления и восстановления марганца можно представить следующим образом:
[Мn] + [O] ↔ (МnO); [Мn] + (FeО) ↔ (МnО) + [Fе].
Как показывают расчетные и экспериментальные данные, с повышением температуры и основности шлака концентрация марганца в металле увеличивается. Это указывает на то, что реакция окисления марганца достигает равновесия и окислительный процесс сменяется восстановительным. Поскольку почти все стали содержат марганец, то его восстановление в процессах плавки – явление желательное.
7
1.2.3. Окисление и восстановление кремния
Кремний обладает еще большим сродством к кислороду, чем марганец, и практически полностью окисляется уже в период плавления. Окисление кремния происходит по реакциям:
[Si] + 2[О]= (SiO2); [Si] + 2(FеО) = (SiO2) + 2[Fе].
При плавке под основным шлаком SiО2 связывается в прочный силикат кальция (СаО)2∙SiO2, что обеспечивает почти полное окисление кремния, содержащегося в шихте. При кислом процессе поведение кремния иное: при горячем ходе кислого процесса имеет место интенсивное восстановление кремния.
1.2.4. Окисление и восстановление фосфора
Фосфор в стали является вредной примесью, отрицательно влияющей на ее механические свойства. Поэтому содержание фосфора в стали в зависимости от ее назначения ограничивается пределом 0,015…0,016 %. Окисление фосфора можно представить следующим образом:
2[Р] + 5(FеО) = (Р2O5) + 5[Fе];
(Р2O5) + 3(FеО) = (FеО)3∙Р2O5;
(FеО)3.Р2O5 + 4(СаО) = (СаО)4·Р2O5 + 3(FеО);
2Р + 5(FеО) + 4(СаО) = (СаО)4·Р2O5 + 5Fе.
Уравнение константы можно записать в следующем виде:
K= |
СaO P2O5 |
. |
|
P2 FeO 5 CaO 4 |
|||
|
|
Откуда коэффициент распределения фосфора между металлом и
шлаком
L = (Р2O5)/Р2 =К · (FеО)5 · (СаО)4.
1.2.5. Десульфация стали
Сера, так же как и фосфор, является вредной примесью в стали. Удаление серы можно представить в виде реакции
Fe2 + [S] +(СаО) = (СаS) + (FеО).
Уравнение для константы имеет вид
K= СaS FeO .

8
Коэффициент распределения серы
L = (S)/[S] = К(СаО)/(FеО).
Из уравнения следует, что повышение основности и снижение окисленности шлака способствуют десульфации. Положительную роль оказывают также повышение температуры металла и активное перемешивание ванны. Повышению степени удаления серы способствуют элементы, образующие сульфиды, более прочные, чем сульфид железа. К таким элементам относятся редкоземельные металлы.
1.2.6. Газы в стали
Газы (кислород, водород и азот) содержатся в любой стали. Газы даже при содержании их в сотых и тысячных долях процента оказывают отрицательное влияние на свойства металла.
Растворимость кислорода в стали характеризуется реакцией
1/2O2 = [O].
В готовом металле содержание кислорода должно быть минимальным. Растворимость водорода и азота в металле подчиняется закону Стивенса:
[Н] = КH
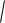 pH ; [N]=K
pH ; [N]=K
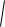 pN ,
pN ,
где pH и pN – парциальные давления газов; КH и KN – растворимость водорода и азота при парциальном давлении соответствующего газа, равном 0,1 МПа.
Уменьшение растворимости при переходе из жидкого в твердое состояние при кристаллизации стали вызывает выделение газов из металла, что является причиной образования ряда дефектов, например, флокенов (мельчайших трещин, образующихся в результате выделения водорода в виде газа), пористости в слитках готовой стали и т.п.
В присутствии некоторых элементов в металле могут образовываться их соединения с азотом – нитриды. Наличие нитридов в кристаллической структуре многих сталей отрицательно влияет на свойства металла.
Азот и водород успешно удаляются из жидкой стали в результате реакции окисления углерода. Образующийся по этой реакции СО собирается в пузырьки, которые вырываются на поверхность металла, пробивают находящийся под металлом слой жидкого шлака и выходят в атмосферу. В результате этого создается впечатление кипения жидкой ванны.
9
Всплывающие пузырьки СО захватывают по пути вверх некоторое количество других газов – Н2 и N2.
Чем энергичнее протекает кипение металла, тем меньше содержание газов и тем лучше качество металла. Для удаления Н2 и N2 применяют также вакуумную обработку, продувку ванны нейтральным газом (аргоном) и др.
1.2.7. Раскисление стали
Для снижения содержания кислорода в стали проводят ее раскисление. Это, как правило, последняя и ответственная операция в процессе выплавки стали. Раскисление –процесс удаления кислорода, растворенного в стали, путем связывания его в оксиды различных металлов, имеющих большее сродство к кислороду, чем железо.
Наиболее распространенными раскислителями являются марганец и кремний, используемые в виде ферросплавов, и алюминий.
Реакции раскисления можно представить следующим образом: [О] + [Мn]= (МnО);
2[О] + [Si] = (SiО2); 3[О] + 2[А1] = (Аl2O3).
Взависимости от условий ввода раскислителей в металл разли-
чают два метода раскисления: глубинное (или осаждающее) и диффузионное.
При глубинном раскислении раскислители вводят в глубину металла. В этом случае требуется определенное время для того, чтобы продукты раскисления – оксиды кремния, марганца, алюминия – всплыли в шлак. При диффузном раскислении раскислители в тонко измельченном виде попадают в шлак, покрывающий металл. Сначала
вэтом случае происходит раскисление шлака, а снижение содержания кислорода в металле осуществляется за счет его перехода из металла
вшлак, т. е. [О] => (О). При диффузионном раскислении не происходит загрязнение металла неметаллическими включениями – продуктами раскисления.
Для более глубокого раскисления применяют обработку жидкого металла в вакууме или синтетическими шлаками.
Взависимости от степени раскисления различают спокойную,
кипящую и полуспокойную сталь.
Спокойная сталь – это сталь, полностью раскисленная, т. е. благодаря вводу большого количества раскислителей весь кислород в стали находится в связанном с элементом-раскислителем состоянии.
