
437
.pdf
Задание 1. Напишите электронные процессы при электролизе расплавов солей и их водных растворов (табл.4).
Таблица 4
Вариант |
Формулы электролитов |
|
|
1 |
Li2Cl2; Bi(NO3)3; CdSO4 |
|
|
2 |
NaNO3; CuSO4; FeCl2 |
|
|
3 |
CaCl2; Sn(NO3)2; CuI2 |
|
|
4 |
MgI2; FeSO4; AgNO3 |
|
|
5 |
Al2(SO4)3; Bi(NO3)3; ZnBr2 |
|
|
6 |
Na3PO4; CuCl2; СdSO4 |
|
|
7 |
MgSO4; CdCl2; CuSO4 |
|
|
8 |
AlCl3; CuBr2; FeCl2 |
|
|
9 |
Mg(NO3)2; CuSO4; ZnCl2 |
|
|
10 |
LiBr; BiCl3; AgNO3 |
|
|
11 |
Al2(SO4)3; Na3PO4; CuBr2 |
|
|
12 |
KNO3; ZnSO4; CuCl2 |
|
|
13 |
Li2SO4 (распл.); Cd(NO3)2; CuSO4 |
|
|
14 |
Ca(NO3)2; CuI2; FeBr2 |
|
|
15 |
MgCl2; FeSO4; Bi(NO3)3 |
|
|
16 |
K2S; FeI2; AgNO3 |
|
|
Задание 2. Решите задачи на законы Фарадея, напишите процессы электролиза при пропускании тока через раствор электролита (табл.5).
Таблица 5
Вариант |
Условие задачи |
|
|
1 |
2 |
1а) Сколько серебра выделится при пропускании через раствор
AgNO3 тока 8А за 15 мин?
б) Какой газ и в каком количестве выделился на аноде при электролизе Cr2(SO4)3 током 1А в течение 15 мин?
33
|
Продолжение табл. 5 |
||
1 |
2 |
|
|
2 |
а) При электролизе водного раствора SnCl2 на аноде выделилось |
||
|
4,48л хлора (условия нормальные). Найти массу выделившегося на |
||
|
катоде олова. |
|
|
|
б) Сколько времени потребуется для электролиза для покрытия 150 |
||
|
см2 катода 0,6мм кадмия, если через раствор CdSO4 пропустили ток |
||
|
силой 2А (плотность кадмия 8,8 г/см3)? |
|
|
|
|
|
|
3 |
а) При электролизе водного раствора Cr2(SO4)3 |
током силой |
2А |
|
масса катода увеличилась на 8г. В течение какого времени |
||
|
проводили электролиз? |
|
|
|
б) Сколько граммов NaOH образовалось у катода при электролизе |
||
|
раствора сульфата натрия, если на катоде выделился водород |
||
|
объемом 5,6л, измеренный при нормальных условиях? |
|
|
4 |
а) Сколько времени необходимо проводить электролиз, чтобы |
||
|
покрыть слоем никеля в 10-2см цилиндрическую деталь размером |
||
|
(высота 10см и радиус 1,5см) при силе тока 2А? Плотность никеля |
||
|
принять равной 8,8 г/см3. |
|
|
|
б) Какая масса никеля выделится из нейтрального водного раствора |
||
|
NiSO4 при пропускании через него в течение 15 мин тока силой 3А |
||
|
(с инертными электродами)? |
|
|
5 |
а) При электролизе раствора Na2SO4 получили при нормальных |
||
|
условиях водорода 448л. Сколько времени протекал электролиз, |
||
|
если ток был 100А? |
|
|
|
б) Чему равна сила тока при электролизе раствора в течение |
|
|
|
1ч 40 мин 25 с, если на катоде выделилось 1,4л водорода, |
||
|
измеренного при нормальных условиях? |
|
|
6 |
а) Электролиз раствора K2SO4 проводили при силе тока 5А в |
||
|
течение 3 ч. Вычислите объем выделяющихся на электродах |
||
|
веществ. |
|
|
|
б) Электролиз нитрата серебра идет 4 ч при силе тока 2А. Сколько |
||
|
граммов серебра при этом выделится на катоде? |
|
|
7 |
а) Электролиз водного раствора K2SO4 |
проводили |
с |
|
нерастворимыми электродами при силе тока 2,68А в течение 1ч. |
||
|
Вычислите объем выделившихся при нормальных условиях на |
||
|
электродах веществ. |
|
|
|
б) Какие вещества и в каком количестве образуются при |
||
|
пропускании тока 6А в течение 1ч через раствор гидроксида калия? |
||
8 |
а) Вычислите массу серебра при пропускании тока силой 6А через |
||
|
раствор AgNO3 в течение 30 мин? |
|
|
|
б) Электролиз водного раствора CuSO4 проводили в течение 15 мин |
||
|
при силе тока 2,5А. Выделилось 0,72г меди. Вычислите выход по |
||
|
току. |
|
|
|
|
|
|
|
34 |
|
|
|
Окончание табл. 5 |
1 |
2 |
9 |
а) Какая масса вещества выделится на катоде и аноде при |
|
электролизе водного раствора KJ, если электролиз проводить в |
|
течение 1ч 35 мин при силе тока 15А? |
|
б) Электролиз водного раствора CuSO4 проводили с медным анодом |
|
в течение 4 ч при силе тока 50А. При этом выделилось 224г меди. |
|
Вычислите выход по току. |
10 |
а) Сколько литров (нормальные условия) газа выделится на аноде |
|
при электролизе водного раствора KOH, если электролиз проводить |
|
в течение 30 мин при силе тока 0,5А? |
|
б) Через раствор CdSO4 пропущен электрический ток силой 25А. |
|
При этом на катоде выделился кадмий массой 42,5г. Вычислите |
|
выход по току. |
11 |
а) Сколько граммов NaOH образовалось у катода при электролизе |
|
раствора сульфата натрия, если на катоде выделился водород |
|
объемом 5,6л, измеренный при нормальных условиях? |
|
б) За 10 мин из раствора платиновой соли ток силой 5А выделил |
|
1,517г платины. Определите ее эквивалентную массу. |
12 |
а) Электролиз раствора AgNO3 проводили при силе тока 5А в |
|
течение 5 ч. Какая масса серебра выделилась на катоде и каков |
|
объем газа (нормальные условия), выделившегося на аноде? |
|
б) Электролиз водного раствора Na2SO4 проводили в течение 5 ч |
|
при силе тока 7А. Какая масса воды при этом разложилась и чему |
|
равны объемы газов (нормальные условия), выделившихся на |
|
катоде и аноде? |
13 |
а) При электролизе водного раствора CuSO4 на аноде выделилось |
|
168 см3 газа (норм. условия). Вычислите массу выделившейся меди. |
|
б) При токе силой 2А в течение 40 мин выделилось на катоде 4,542г |
|
некоторого материала. Вычислите эквивалент этого металла. |
14 |
а) При электролизе водного раствора AgNO3 в течение 25 мин при |
|
силе тока в 3А на катоде выделилось 4,8г серебра. Вычислите выход |
|
по току. |
|
б) Сколько времени требуется для выделения 20г Na при силе тока |
|
50А? |
15 |
а) Вычислите объем водорода, выделенного при пропускании тока |
|
5А в течение 1ч через раствор серной кислоты. |
|
б) Вычислите время, необходимое для выделения 50г Fe из раствора |
|
соли Fe2(SO4)3, если электролиз проводится током 10А. |
16 |
а) Сколько литров (нормальные условия) газа выделится на аноде |
|
при электролизе водного раствора KOH, если электролиз проводить |
|
в течение 130 мин при силе тока 10,5А? |
|
б) Электролиз водного раствора CuSO4 проводили в течение 15 мин |
|
при силе тока 2,5А, выделилось 0,72г меди. Вычислите выход по |
|
току. |
|
35 |
КОРРОЗИЯ
Известно, что металлы обладают ценными свойствами. Им характерны механическая прочность, ковкость, пластичность, электро- и теплопроводность, поэтому они широко распространены во всех областях техники, являясь ценным конструкционным материалом. Однако металлы обладают крупным недостатком: они подвержены коррозии. Коррозия в переводе с латинского языка означает разъедание, разрушение. Коррозией называется процесс разрушения металлов при их физико-химическом взаимодействии с окружающей средой.
Коррозия − самопроизвольный процесс, сопровождается уменьшением энергии Гиббса (ΔG < 0). Коррозия металлов− нежелательный процесс. Безвозвратные потери металлов составляют 10 % от ежегодного их выпуска. Разрушение и потери готовых металлических изделий сопровождаются большими экономическими затратами. Поэтому предупреждение коррозии – важная народнохозяйственная задача.
В результате коррозионных разрушений изменение поверхности металла может быть различным. Это зависит от свойств металла и условий протекания коррозии. Дефекты могут быть макроскопические и микроскопические. К макроскопической коррозии относятся местная и равномерная. Наиболее опасной является местная коррозия, так как при этой коррозии в отдельных местах может быть создана концентрация механических напряжений, содействующая дополнительному растрескиванию. К местной коррозии относятся: коррозия пятнами, точечная и ниттинг.
Микроскопические разрушения опасны все. К ним относятся: 1) интеркристаллическая коррозия – ослабляет связь между металлическими зернами; 2) транскристаллическая – возникает под действием механических напряжений и приводит к развитию трещин; 3) селективная коррозия – считается менее опасной, т.к. возникает как результат травления стали при сохранении карбидных зерен (цементита FeC) или потере цинка из латуней (62 % Cu и 38 % Zn).
Определение скорости коррозионных разрушений различно, чаще используют массовый или глубинный методы.
Массовый метод дает потерю массы образца в массовых единицах (г, кг и т.д.) за единицу времени (с, ч, сутки, год), отнесенную к единице площади(мм2,см2,м2 ит.д.)испытуемогообразца.
36
Глубинный показатель выражается уменьшением толщины металла в единицу времени.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия. Химическая коррозия характерна для сред, не проводящих электрический ток и в отсутствии электролита. При химической коррозии происходит прямое взаимодействие металла с окислителем окружающей среды.
По условиям протекания химической коррозии различают:
а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Например, газовой коррозии подвергаются режущие инструменты при большой скорости обработки металла, лопатки газовых турбин, выхлопные патрубки, сопла, двигатели поршневого и турбинного типов, ракетные двигатели;
б) коррозию в неэлектролитах – агрессивных органических жидкостях (топливе, масле), например таких, как сернистая нефть и др. При этом разрушаются цилиндры двигателей внутреннего сгорания. При сгорании топлива соединения серы превращаются в
SO2 и SO3.
Наиболее сильными окислителями могут быть О2, F2, Cl2, SO2, SO3. Их агрессивное действие по отношению к металлам разное. Например, алюминий и его сплавы, хром и стали с высоким содержанием хрома устойчивы в атмосфере кислорода, но совершенно не устойчивы в присутствии хлора; никель не устойчив в атмосфере SO2, а медь вполне устойчива. Однако никель, по сравнению с другими металлами, устойчив в атмосфере фтора; коррозия низколегированных и углеродистых сталей в выхлопных газах двигателей внутреннего сгорания, в топочных и печных газах сильно зависит от соотношения СО и О2. Повышение содержания кислорода увеличивает скорость газовой коррозии, а повышение угарного газа (СО) ослабляет коррозию.
Ряд металлов (Co, Ni, Cu, Pb, Cd, Ti) устойчив в атмосфере чистого водяногопарапритемпературевышетемпературыкипенияводы.
Скорость химической коррозии зависит от многих факторов:
1)в первую очередь от характера продуктов коррозии. В процессе окисления на поверхности металла чаще образуется твердая пленка оксидов;
2)от скорости диффузии окислителя через оксидную пленку;
37
3) от сплошности оксидной пленки, которая создает низкую диффузионную способность окислителя.
Процессы диффузии в оксидных слоях могут происходить за счет перемещения кислорода из газовой фазы по направлению к металлу или ионов Men+ в противоположном направлении. При диффузии кислорода из газовой фазы в глубину пленки двигаются не ионы, а атомы кислорода, которые в оксидной пленке ионизируются (О0+2e-→ О2-) и, встречаясь с ионами Men+, образуют оксид, при этом увеличивается толщина оксидной пленки, уменьшается толщина металла, а толщина корродирующего образца не меняется.
Если преимущественно перемещаются ионы Men+, то оксидная пленка растет в сторону газовой фазы (О2), размер корродирующего образца увеличивается. Может быть и промежуточный случай – одновременного движения кислорода и ионов Men+, что вызывает рост пленки в обоих направлениях.
Электрохимическая коррозия. Электрохимическая коррозия характерна для сред, проводящих электрический ток, обычно это растворы электролитов (имеющие ионную проводимость). Электрохимической коррозией называется разрушение металла под действием микро- и макрогальванических пар в среде электролита.
Электролитическая коррозия слагается из двух процессов: анодного окисления и катодного восстановления. Процесс анодного растворения (окисления) металла составляет суть электрохимической коррозии. Иначе говоря, механизм электрохимической коррозии определяется разностью потенциалов пассивных (катодных) и активных (анодных) участков, т.е. сводится к работе гальванического элемента. По характеру катодного процесса различают коррозию с водородной и кислородной деполяризацией.
Электрохимическая коррозия может протекать:
1)в электролитах – в водных растворах солей, кислот, оснований, в морской и речной водах, в почве;
2)в атмосфере влажного газа (атмосферная коррозия);
3)под действием блуждающих токов.
Металлические конструкции, работающие в контакте с электролитами, особенно сильно подвергаются коррозии. Это химическая аппаратура и цистерны для перевозки кислот и другой химической продукции, корпуса морских и речных судов, подводные сооружения в портах и донах.
38
Почвенную коррозию можно отнести к коррозии в электролитах, т.к. почва бывает кислой, щелочной, нейтральной; в почвах содержатся различные электролиты. Под действием электролитов, содержащихся в почвах, коррозии подвергаются трубопроводы, металлические опоры и сваи, мачты электропередач и т.д.
Атмосферной коррозии подвержены металлические конструкции и изделия,которыеэксплуатируютсяватмосферныхусловиях.
Большую роль в коррозии подземных сооружений играет блуждающий электрический ток. Источником блуждающего электрического тока являются установки, работающие на постоянном токе: электросварочные аппараты, трамваи, метро, электрифицированная железная дорога и т.д. При определенных обстоятельствах создается возможность утечки тока в землю с анодного участка и возвращение его на катодные участки. Блуждающие токи действуют в радиусе нескольких километров. Если на пути блуждающего тока встречается, например, металлическая труба, то место входа блуждающего тока будет катодным участком,
т.е. К «+», а место выхода – анодом А«−». Анодный участок трубы разрушается, т.е. корродирует: Fe0 – 2e− → Fe+2, а на катоде
восстанавливаются ионы Н+: 2H+ + 2e−→ H20↑.
Величина блуждающего тока определяет интенсивность коррозии и степень разрушения металла. Блуждающие токи возникают в конструкциях при нарушении изоляции. Рассмотрим, как записать с помощью химических уравнений процесс коррозии в электролитах. Например, железное изделие с медными заклепками опущено в водный раствор соляной кислоты. В этом случае контактируют два металла: железо и медь, образуя микрогальваническую пару, имеется поверхность раздела фаз,
которая отмечается чертой. |
|
Итак, запишем: А«-» |
К«+» |
Fe/Cu
HCl
В этом микрогальваническом элементе железо является анодом (более активный металл), а медь – катодом. Рассмотрим электронные
процессы на электродах:
«−»А Fe0 – 2e− → Fe2+ (окисление);
«+»К 2Н+ + 2e− → 2H0; 2Н0 = Н2↑ (восстановление) выделяется газ водород.
39
Электрохимическая коррозия, которая сопровождается выделением водорода, называется коррозией с водородной деполяризацией. Интенсивность выделения газа водорода сопровождается интенсивной коррозией металла, т.е. существует прямо пропорциональная зависимость. Водород является деполяризатором (усилителем) коррозионного процесса.
С поверхности меди идет выделение газообразного водорода. Продуктом коррозии является FeCl2 по уравнению Fe2+ + 2Cl− =FeCl2, коррозии подвергается более активный металл, т.е. анод. Рассмотрим, как с помощью химических уравнений записать процесс атмосферной коррозии.
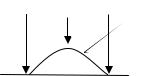
В классическом варианте средой, в которой происходит атмосферная коррозия, является влажный воздух, главные компоненты которого кислород и пары воды (Н2О + О2). На поверхности металлической конструкции в атмосферных условиях
конденсируется вода в окружении кислорода (рис. 7). |
|
|
|
|
Капля |
||||
|
O2 |
||||||||
Участок, который контактирует с кислородом, |
|
|
|
|
|
|
воды |
||
|
|
|
|
|
|
|
|
|
|
т.е. концентрация газа высокая, является катод- |
|
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
O2 |
|||
ным участком. Там где концентрация кислорода |
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
||
«+»К |
|
|
|||||||
меньше (середина капли воды) – анодный учас- |
А«−» К«+» |
||||||||
|
|
|
|
|
|
|
|
|
|
ток. Запишем электронные процессы на элект- |
|
|
|
|
|
|
|
|
|
родах: |
Рис.7. Атмосферная |
||||||||
«−»А Fe0 – 2e− → Fe2+ (окисление) |
коррозия на поверхнос- |
||||||||
«+»К 2Н2О+ О2+4e− → 4ОH−(восстановление). ти железной пластинки На аноде – окисление железа, на катоде
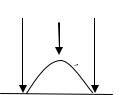
(записывается среда в атмосфере влажного газа) идет восстановление до образования ОН- групп. Так как это микроучасток, образовавшиеся ионы железа Fe2+ и гидроксильные группы взаимодействуют между собой по правилу валентности Fe2+ + 2ОН− = Fe(ОН)2, образуется дигидроксид двухвалентного железа, который, являясь сильным восстановителем, окисляется кислородом воздуха во влажной среде до Fe(OH)3 по уравнению 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 – это ржавчина, продукт коррозии. Формулу ржавчины можно записать еще так: Fe2O3∙nH2O. Только сплавы железа корродируют до ржавчины, т.к. железо является черным металлом (остальные металлы цветные). Рассмотрим коррозию цветного металла, например, магния и его сплавов (рис.8).
40
|
|
|
|
|
|
|
Капля |
|
«−»А Mg0 |
– 2e− → Mg2+ (окисление); |
||
|
|
|
|
O2 |
||||||||
|
|
|
|
|
|
|
воды |
|
«+» К 2Н2О+О2 + 4e− → 4ОH− (восстановление); |
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Mg2+ +2ОH− = Mg(OH)2 – это продукт коррозии. |
||
|
|
|
|
|
|
|
|
|
|
|||
|
O2 |
|
|
|
|
O2 |
Mg |
|||||
|
|
|
|
|
Коррозия, которая сопровождается поглоще- |
|||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
«+»К |
А«−» |
К«+» |
нием кислорода, называется коррозией с кисло- |
|||||||||
|
|
|
|
|
|
|
|
|
|
родной деполяризацией. В этом случае деполя- |
||
|
|
|
|
|
|
|
|
|
|
затором (усилителем) коррозионного процесса |
||
Рис.8.Атмосферная |
является кислород. |
|
||||||||||
коррозия на поверх- |
Рассмотрим пример решения задачи на кор- |
|||||||||||
ности |
магниевой |
розионный процесс. Имеются две пары контак- |
||||||||||
пластины |
|
|
|
|
|
тирующих |
металлов: |
алюминий с никелем в |
||||
|
|
|
|
|
|
|
|
|
|
атмосфере влажного |
газа; алюминий с медью |
|
в растворе серной кислоты. Какой металл корродирует в контактах? Где интенсивнее коррозионный процесс?
1) |
А«-» К«+» |
«−»А Al0 – 3e− → Al3+ (окисление); |
|
Al/Ni |
«+»К 2Н2О+ О2 + 4e− → 4ОH− (восстановление); |
|
H2O + O2 |
Al3+ + 3ОH− = Al(OH)3 – это продукт c |
кислородной деполяризацией коррозии. |
||
2) |
А«-» К«+» |
«−»А Al0 – 3e− → Al3+ (окисление); |
|
Al/Cu |
«+»К 2Н+ + 2e− → H20 (восстановление) |
|
H2SO4 |
с водородной деполяризацией; |
|
|
Al3+ + SO42− = Al2(SO4)3 – продукт коррозии. |
В двух контактах алюминий более активный металл, он является анодом. Корродирует анод.
Потенциал катодного процесса в первом случае: φ0 (О2 + 2Н2О + 4e−→ 4OH−) = 0,401 В.
Потенциал второго процесса:
φ0 (2Н+ + 2e− → H20) = 0,0 В при рН=1; ЭДС1 = 0,401−(−1,66) = 2,07 В; ЭДС2 = 0−(−1,66) = 1,66 В.
Там, где выше ЭДС, сильнее коррозионный процесс. В контакте алюминия с медью алюминий будет сильнее корродировать, сильнее разрушаться.
Задание 1. Два металла находятся в контакте. Какой металл будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (HCl)? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии (табл.6)?
41
|
|
|
Таблица 6 |
Вариант |
Контактирующие металлы |
Вариант |
Контактирующие металлы |
1 |
Ni; Cu |
9 |
Sn; Fe |
2 |
Mn; Fe |
10 |
Cd; Zn |
3 |
Zn; Mg |
11 |
Mn; Pb |
4 |
Al; Bi |
12 |
Ni; Mn |
5 |
Al; Pb |
13 |
Cr; Cu |
6 |
Ti; Ni |
14 |
Cu; Ni |
7 |
Zn; Cu |
15 |
Mg; Bi |
8 |
Fe; Cu |
16 |
Pb; Cd |
Задание 2. Одним из способов защиты металлических изделий от коррозии является покрытие другим металлом. Какой металл по отношению к покрываемому металлу является анодом или катодом? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии изделия при нарушении покрытия во влажном воздухе. Какие продукты коррозии при этом образуются (табл.7)?
|
Таблица 7 |
Вариант |
Изделие или металл, покрытые другим металлом |
|
|
1 |
Алюминий спаян со свинцом |
2 |
Магний спаян с оловом |
3 |
Марганец покрыт медью |
4 |
Железное изделие покрыто хромом |
5 |
Медь покрыта оловом |
6 |
Луженое железо |
7 |
Оцинкованное железо |
8 |
Алитированное железо |
9 |
Луженая медь |
10 |
Железное изделие покрыто кадмием |
11 |
Железное изделие покрыто свинцом |
12 |
Железное изделие покрыто никелем |
13 |
Алюминий смешан с медью |
14 |
Олово спаяно с серебром |
15 |
Железо покрыто хромом |
16 |
Медь покрыта оловом |
Задание 3. Контактируют две пары металлов. В каком случае идет интенсивнее коррозия и какой металл корродирует? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии в атмосфере влажного газа и в растворе кислоты (H2SO4). Каков состав продуктов коррозии (табл.8)?
42
