
437
.pdf
|
Окончание табл. 3 |
|
|
1 |
2 |
|
|
|
Cu+2 (1M)│Cu ║ Ag+1 (1M) │ Ag |
10 |
Mg+2 (0,1M) │Mg ║ Zn+2 (0,01M)│Zn |
|
Cd+2 (10M)│Cd║Cd│Cd+2 (0,1M) |
|
|
|
Zn+2 (1M)│Zn ║ Ni+2 (1M) │Ni |
11 |
Cu+2 (10M)│Cu║ Cu│ Cu+2 (1M) |
|
Mg+2 (0,1M) │Mg ║ Co+2 (1M)│Co |
|
|
|
Ni+2 (0,1M) │Ni ║ Ni│ Ni+2 (1M) |
12 |
Mg+2 (1M) │Mg ║ Zn+2 (0,1M)│Zn |
|
Zn+2 (1M)│Zn ║ Ag+1 (1M) │ Ag |
|
|
|
Al│ Al+3 (1M)║ Co│ Co+2 (1M) |
13 |
Cu+2 (1M)│Cu║ Cu│ Cu+2 (0,1M) |
|
Ni│ Ni+2 (0,1M) ║ Pb │ Pb+2 (10M) |
|
|
|
Mg+2 (1M) │Mg ║ Ni+2 (1M) │Ni |
14 |
Co+2 (1M)│Co║ Co│ Co+2 (0,01M) |
|
Zn│ Zn+2 (1M)║ Cu│ Cu+2 (1M) |
|
|
|
Cu│Cu+2 (1M)║ Ag │ Ag+1 (1M) |
15 |
Zn│ Zn+2 (0,1M)║ Ni│ Ni+2 (10M) |
|
Cu+2 (0,1M)│Cu║ Cu│ Cu+2 (1M) |
|
|
|
Al│ Al+3 (1M)║ Pb │ Pb+2 (1M) |
16 |
Fe │ Fe+2 (10M)║ Cu│ Cu+2 (0,1M) |
|
Zn│ Zn+2 (1M)║ Zn+2 (0,01M)│Zn |
|
|
|
ЭЛЕКТРОЛИЗ |
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах при прохождении постоянного электрического тока через раствор электролита или через его расплав.
Электрод, соединенный с отрицательным полюсом источника тока, называется катодом. Электрод, соединенный с положительным источником тока, называется анодом. При этом на катоде происходит
23
процесс восстановления (присоединение окислителем электронов), на аноде – процесс окисления (отдача электронов восстановителем). Таким образом, в процессах электролиза электрическая энергия переходит в химическую.
Ячейка для электролиза называется электролизером, она состоит из двух электродов и электролита.
Следует различать электролиз расплавленных электролитов и электролиз растворов (с участием воды).
Электролиз расплава электролитов
Например, через расплав хлорида натрия пропущен постоянный электрический ток. NaCl 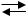 Na+ + Cl−, в расплаве содержатся ионы Na+ и Cl−. При прохождении электрического тока начинается направленное движение ионов, и на электродах будут происходить следующие реакции: ионы Na+ движутся к катоду (эти ионы называются катионами), на котором происходит восстановление: Na+ + 1e− → Na0. Ионы Cl− движутся к аноду (эти ионы называются анионами), где окисляются до хлора: 2Cl− − 2e− → 2Cl0, 2Cl0 = Cl2↑.
Na+ + Cl−, в расплаве содержатся ионы Na+ и Cl−. При прохождении электрического тока начинается направленное движение ионов, и на электродах будут происходить следующие реакции: ионы Na+ движутся к катоду (эти ионы называются катионами), на котором происходит восстановление: Na+ + 1e− → Na0. Ионы Cl− движутся к аноду (эти ионы называются анионами), где окисляются до хлора: 2Cl− − 2e− → 2Cl0, 2Cl0 = Cl2↑.
Итак, при электролизе расплава NaCl образуются следующие вещества: металлический натрий и газообразный хлор. Рассмотрим электролиз расплава щелочи NaОН. NaОН 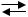 Na+ + ОН−, состоит из ионов Na+ и ОН− групп.
Na+ + ОН−, состоит из ионов Na+ и ОН− групп.
В расплаве ионы Na+ движутся к катоду, идет восстановление катионов: Na+ + 1e− → Na0.
ОН− группы (анионы) направлены к аноду, где идет процесс
окисления с образованием молекул воды и кислорода: 4OH− − 4e− → 4(OH−) → 2H2O + O2.
Рассмотрим пример электролиза расплава кислородной соли
сульфата натрия. При электролизе расплава Na2SO4 в расплаве содержатся ионы Na+ и SO42−(Na2SO4  2 Na+ + SO42−). На катоде идет
2 Na+ + SO42−). На катоде идет
процесс восстановления ионов Na+ до металлического натрия: 2Na+ + 2e− → 2Na0.
На аноде происходит окисление ионов SO42− до SO3
(устойчивый оксид в условиях электролиза) и кислорода: 2SO42− − 2∙2e− → 2(SO42−) → 2SO3 + O2.
При электролизе расплавов NaОН и Na2SO4 образуются неустойчивые молекулы (OH0 и SO40), которые тут же разлагаются на О2 и устойчивый в условиях электролиза оксид неметалла.
24
Можно привести примеры электролиза расплава на аноде с анионами других кислот:
1) анион азотной кислоты:
2NO3− − 2∙1e− → 2(NO3−) → 2NO2 + O2.
В этом случае энергетически более выгодно окисляться до устойчивого оксида NO2;.
2) анион фосфорной кислоты:
4PO43− − 4∙3e− → 4(PO43−) → 2P2O5 + 3O2.
Образуется устойчивый оксид пятивалентного фосфора.
Электролиз водных растворов электролитов
При электролизе водных растворов солей (кроме ионов, из которых состоит данная соль, еще имеются молекулы воды) на процесс оказывают влияние молекулы воды.
При электролизе водных растворов солей катодное восстановление и анодное окисление подчиняется своим закономерностям.
Катодное восстановление. Катодное восстановление определяется положением металлов в ряду напряжения и потенциалом восстановления ионов водорода. В ряде случаев большое значение имеет рН раствора.
Металлы, расположенные в электрохимическом ряду напряжения (рис.4), делятся на активные (от начала ряда до Ti включительно), средней активности (от Mn до Pb), малоактивные металлы, т.е. которые стоят после водорода (от Bi до Au). Если электролизу подвергаются водные растворы солей активных металлов, на катоде идет восстановление воды до образования газообразного водорода и анионов гидроксильных групп ОН−, а катионы активных металлов не принимают участия в процессе электролиза.
Рассмотрим пример № 1. Электролиз водного раствора сульфата натрия. Эта соль состоит из ионов активного металла и ионов
кислородной кислоты. Сульфат натрия распадается на частицы: ионы Na+ и ионы SO42−. Na2SO4 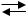 2 Na+ + SO42−, которые окружены
2 Na+ + SO42−, которые окружены
молекулами воды. Известно, что молекула воды представляет собой диполь  . Положительно заряженные частицы окружены молекулами воды, ориентированными отрицательным полюсом, а отрицательно заряженные частицы окружены молекулами воды,
. Положительно заряженные частицы окружены молекулами воды, ориентированными отрицательным полюсом, а отрицательно заряженные частицы окружены молекулами воды,
25
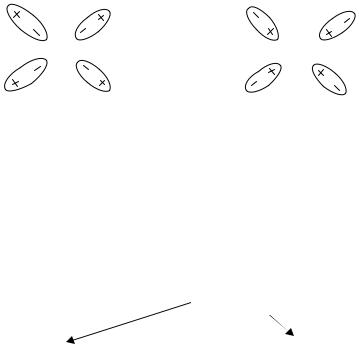
ориентированными положительным полюсом. Для частиц водного раствора Na2SO4 это будет выглядеть так (рис.6).
Na+ |
+ |
SO42− |
Рис.6. Гидратированные ионы Na+ и SO42−
При прохождении постоянного электрического тока начинается направленное движение гидратированных частиц: гидратированные ионы натрия Na+ направлены к катоду, а гидратированные сульфат ионы SO42− − к аноду. Для того чтобы не рисовать гидратированные ионы, следует писать
Na2SO4 
р−р
«−» К |
А «+» |
2 Na+ |
SO42− |
2H2O + 2e− → H2 + 2OH− |
2H2O − 4e− → O2 + 4H+ |
2Na+ + 2OH− = 2NaOH |
SO42− + 2H+ = H2SO4 |
Так как ионы Na+ слабые окислители, они не могут принимать электроны, следовательно, они не принимают участие в процессе электролиза. Восстановлению подвергается вода с образованием газообразного водорода и анионов OH− групп (см. катодный процесс). Существующие в катодном пространстве ионы Na+ и образующиеся ионы OH- образуют щелочь NaOH: Na+ + OH− = NaOH. На катоде щелочная среда, т.е. рН = 14. Концентрация ионов водорода 10-14 моль/л. По уравнению Нернста можно определить потенциал восстановления ионов водорода: φ/ = φ0 + 0,059/n∙lg [Н+], φ/ = 0 + +0,059/1∙lg [10−14] ≈ − 0,83 В.
Активные металлы имеют более отрицательное значение стандартных электродных потенциалов по сравнению с водородом в щелочной среде, поэтому ионы данных металлов не способны принимать электроны. Если электролизу подвергаются водные растворы солей металлов средней активности, то на катоде идет восстановление ионов металла и воды до образования газообразного водорода и анионов гидроксильных групп.
Рассмотрим пример № 2. Электролиз водного раствора нитрата цинка. При прохождении постоянного электрического тока через
26
раствор соли происходит направленное движение гидратированных частиц:
Zn(NO3)2 |
Zn2+ + 2NO3− |
р−р |
Н2О Н2О |
«−» К |
А «+» |
|
NO3− |
Zn2+ + 2e− → Zn0 |
2H2O − 4e− → O2 + 4H+ |
2H2O + 2e− → H2 + 2OH− |
2NO3− + 2H+ = 2HNO3 |
2OH− + 2H+ = 2H2O
На катоде: восстановление ионов цинка и восстановление воды до газообразного водорода и ионов OH− групп. Это два противоборствующих процесса в нейтральной среде, т.е. рН = 7, концентрация ионов водорода равна 10−7 моль/л. По уравнению
Нернста потенциал восстановления ионов Н+ равен φ/ = 0 + 0,059/1∙lg [10−7] ≈ − 0,413 В.
При сравнении стандартных потенциалов металлов средней активности и водорода можно было бы сделать вывод о невозможности восстановления ионов этих металлов на катоде. Однако известно, что при электролизе происходят катодное и анодное перенапряжения. Катодное перенапряжение – это дополнительное напряжение, прикладываемое к катоду (при этом потенциал катода смещается далее в отрицательную сторону). Анодное перенапряжение
– потенциал анода смещается далее в положительную сторону. Особенно большое значение имеет катодное напряжение с
выделением газа водорода. В данном примере водородное перенапряжение электрода больше, чем перенапряжение цинкового электрода, но при повышении плотности тока на электроде начинает выделяться цинк.
Для электролиза водного раствора солей металлов средней активности высокое водородное перенапряжение – явление положительное. Вследствие этого из водных растворов солей удается выделить на катоде Mn, Zn, Cr, Fe, Co, Ni и др. металлы.
При электролизе водных растворов солей малоактивных металлов на катоде идет восстановление ионов данных металлов, вода не принимает участия в процессе электролиза.
Рассмотрим пример № 3. Электролиз водного раствора соли CuI2. Эта соль состоит из ионов меди Cu2+ малоактивного металла и ионов 2I-, бескислородной кислоты (HI). При прохождении
27

постоянного электрического тока через данный раствор соли начинается направленное движение гидратированных ионов к полюсам электрического тока. Ионы меди Cu2+ направляются к
катоду, а ионы 2I− к аноду:
СuI2  Cu2+ + 2I− р-р Н2О Н2О
Cu2+ + 2I− р-р Н2О Н2О
«−» К |
А «+» |
Сu2+ + 2e− → Cu0 |
2I− −2e− → 2I0; 2I0 = I2 |
H2O |
H2O |
Ионы меди восстанавливаются, а вода не принимает участия в процессе электролиза. В случае малоактивных металлов потенциал восстановления ионов водорода в нейтральной среде равен φ/ 2Н+/Н2 = = − 0,413 В. Потенциал восстановления ионов водорода −более низкая величина, чем потенциалы восстановления малоактивных металлов, поэтому ионы данных металлов будут легко восстанавливаться на катоде. Таким образом, в общем случае при электролизе на катоде легче восстанавливаются те ионы, атомы и молекулы, потенциалы которых наиболее высокие.
Анодное окисление. Анод бывает инертным и активным. Инертным называется анод, материал которого не подвергается окислению (это металлы).
Рассмотрим анодные процессы при электролизе водных растворов солей с инертным анодом. Если электролизу подвергаются растворы кислородосодержащих кислот (H2SO4, HNO3, H3PO4 и т.д.) и их солей, а также (в качестве исключения) фтористо-водородная кислота (HF) и ее соли, то окислению подвергается вода до газообразного кислорода и катионов Н+. Кислородосодержащие анионы не принимают участия в процессе электролиза, они остаются без изменения.
В водном растворе сульфата натрия (пример № 1) анионы SO42− не принимают участия в процессе электролиза, окислению подвергается вода. В растворе, в анодном пространстве образуется
серная кислота:
SO42− + 2H+ = H2SO4.
В водном растворе нитрата цинка (пример № 2) анионы NO3− не принимают участия в процессе электролиза, а в анодном пространстве
образуется азотная кислота:
NO3− + H+ = HNO3.
28
В рассмотренных примерах № 1 и 2 электрохимическое окисление воды является наиболее выгодным процессом. Кислородосодержащие анионы или не способны окисляться или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления ионов 2SO42− −2e−  S2O82− равен
S2O82− равен
+2,01В; φ0 Н2O/O2 + 4H+ = +1,228В; φ0 2F−/F2 = + 2,866В. Потенциал окисления воды меньше, чем потенциал окисления анионов SO42−, поэтому окислению подвергается вода.
При электролизе водных растворов бескислородных кислот (HCl, HBr, HI и т.д.) и их солей, кроме HF и ее солей, на аноде идет окисление анионов бескислородных кислот, вода не принимает участия в процессе электролиза.
При электролизе водного раствора CuI2 (пример № 3) на аноде происходит окисление ионов йода, т.к. это ионы бескислородной
кислоты (HI), вода не принимает участия в процессе электролиза, т.е. 2I− −2e− → 2I0; 2I0 = I2.
Потенциалы окисления анионов бескислородных кислот довольно низкие по сравнению с потенциалом окисления воды.
Например: φ0 2I−/I2 = + 0,536В; φ0 2Br−/Br2 = +1,087В; φ0 2Cl−/Cl2 = = +1,359В.
Потенциал окисления хлора выше, чем потенциал окисления воды, однако на аноде идет окисление ионов хлора: 2Cl− − 2e− → 2Cl0. Это связано с явлением перенапряжения на аноде – это когда материал анода оказывает тормозящее действие на процесс выделения кислорода, а следовательно, и на процесс окисления воды. Таким образом, в общем случае на аноде легче окисляются те ионы, атомы, молекулы, потенциалы которых в данных условиях наиболее низкие.
Анодное окисление с активным анодом
Пример № 4. Рассмотрим электролиз NiSO4 с никелевым
анодом.
φ0 Ni+2/Ni = − 0,25 В > φ0 Н2O/Н2 + 2OH− = − 0,413 В. Поэтому при электролизе нейтрального раствора NiSO4 на катоде идет восстановление ионов Ni+2. На аноде происходит окисление металла, так как потенциал никеля намного меньше потенциала окисления воды (φ0 Н2O/O2 + 4H+ = + 1,228В) и потенциала окисления SO42−
29
(φ0 2SO42-− 2e−  S2O82− = +2,01В). В данном случае электролиз сводится к растворению металла никеля на аноде и выделению его на катоде. Реакция протекает по уравнению
S2O82− = +2,01В). В данном случае электролиз сводится к растворению металла никеля на аноде и выделению его на катоде. Реакция протекает по уравнению
К«−» Ni2+ + 2e− → Ni0;
А«+» Ni0 – 2e− → Ni2+.
Анодное окисление при электролизе с активным анодом применяется для отчистки металла от примесей (электролитическое рафинирование), для защиты покрытия от коррозии, для ремонта деталей, для декоративного покрытия.
Законы Фарадея. Выход по току
В 1833г. английский ученый Фарадей открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде.
Первый закон Фарадея. Количество вещества, образующегося при электролизе, прямо пропорционально количеству прошедшего электричества:
m = k∙Q,
где m – количество вещества, г; Q – количество электричества, Кл, Q = I∙t,
где I – сила тока, А; t – время, с; k – электрохимический эквивалент вещества, выражающий количество вещества, прореагировавшего в результате протекания количества электричества.
Итак,
m = k I∙t.
Второй закон Фарадея. В последовательно включенных электролизерах массы выделившихся на электродах веществ прямо пропорционально их эквивалентным массам: m1:m2:m3 ... = Э1:Э2:Э3…, где Э – эквивалентная масса. Если масса одного из превращенных веществ при прохождении определенного количества электричества оказалась равной его эквивалентной массе (m1=Э1), то тогда и для других веществ окажутся справедливыми равенства: m2=Э2; m3=Э3 и т.д.
Таким образом, для превращения эквивалентной массы любого вещества требуется одно и то же количество электричества, называемое числом Фарадея (F). F = 96500 Кл, т.е. при прохождении 96500 Кл получают 1 моль-эквивалент вещества.
30
На основании второго закона Фарадея можно записать: k = Э/F.
Объединенное уравнение Фарадея:
m Э I t , F
где Э – эквивалентная масса; F – число Фарадея.
Уравнениями, выражающими законы Фарадея, пользуются для различных расчетов в электрохимии. На законах Фарадея основан самый точный способ измерения количества электричества, прошедшего через электролитическую цепь. Он заключается в определении количества вещества, выделившегося при электролизе на электроде.
Объединенное уравнение Фарадея впоследствии было уточнено добавлением выхода по току, т.е.
η m факт 100% .
m теор
Можно иначе рассчитать выход по току:
η Q/ 100%,
Q
где Q/− количество полезно затраченного электричества, прошедшего через цепь; Q – общее количество электричества.
Для газов объединенное уравнение Фарадея имеет вид
V Vэкв I t η, F
где V − объем выделившегося газа; Vэкв − эквивалентный объем. Рассмотрим примеры решения задач на законы Фарадея. Пример № 1. Вычислить количество серебра, выделенного при
пропускании через раствор AgNO3 тока 5А в течение 10 мин.
Дано: |
Решение: |
|
J = 5A |
1) написать процесс электролиза раствора AgNO3 |
|
t = 10 мин |
AgNO3 |
Ag+ + NO3− |
m − ? |
р−р |
Н2О Н2О |
К «−» |
|
А «+» |
Ag+ + e− → Ag0 |
2H2O – 4e− → O2 + 4H+ |
|
|
|
NO3− + H+ = HNO3; |
31

2) определить массу серебра по уравнению
|
Э I t |
107,9 5 600 |
|
||
m |
|
= |
|
3,36 |
г. |
|
96500 |
||||
|
|||||
|
F |
|
|
||
Пример № 2. Сколько времени необходимо проводить ток силой 2А для получения 5г железа при электролизе водного раствора сульфата железа?
Дано: |
|
Решение: |
|
|
J = 2A |
|
1) написать процесс электролиза раствора FeSO4 |
||
m = 5г |
|
|
FeSO4 |
Fe2+ + SO42− |
t = ? |
|
|
р−р |
Н2О Н2О |
|
|
|
|
А «+» |
|
К «−» |
|
||
Fe+2 + 2e−→Fe0 |
|
2H2O – 4e− → O2 + 4H+ |
||
2H2O + 2e−→H2 + 2OH− |
|
SO42− + 2H+ = H2SO4 |
||
|
|
|
2OH− + 2H+ = 2H2O |
|
Пример № 3. Какие вещества и в каком количестве выделятся при прохождении 48250 Кл через расплав хлорида меди?
Дано: |
|
|
Решение: |
|
|
Q = 48250 Кл |
|
1) написать процесс электролиза расплава MgCl2 |
|||
m - ? |
|
|
|
MgCl2 |
Mg2+ + 2Cl− |
|
|
|
|
р−в |
|
|
К «−» |
|
|
|
А «+» |
|
|
|
|||
Mg2+ + 2e− → Mg0 |
|
2Cl− – 2e− → 2Cl0; 2Cl0 = Cl2↑ |
|||
При электролизе расплава MgCl2 образуются магний и газообразный хлор.
2) для определения массы выделившихся веществ известно, что при прохождении 96500 Кл выделяется 1г – эквивалент вещества. Составим пропорцию:
96500 Кл – 1г-экв. |
|
48250 |
|
|
48250 Кл – хг-экв. |
x |
0,5г-экв. |
||
|
||||
|
96500 |
|
||
32
