
Основы электрохимии. Электролиз. Часть 1
.pdf5. В случае нейтральных или щелочных сред выделение водорода является результатом электрохимического восстановления воды:
2H2O + 2ē = H2о + 2OH– . |
(9) |
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В определенных случаях большое значение имеют рН раствора, концентрация электролита и другие условия электролиза.
1.5. Анодные процессы
При рассмотрении анодных процессов следует различать электролиз с инертным (нерастворимым) анодом (например, графит, уголь, платина). Эти электроды не претерпевают изменений в процессе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза (Cu, Ag, Ni).
Примечания.
1. На инертном электроде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтора и фторидов происходит окисление воды с выделением кислорода. В зависимости от значения рН раствора этот процесс может проходить различным образом:
а) в щелочной среде преобладает процесс разряда гидроксильных ионов:
4ОН- – 4ē = 2Н2О + О2о; |
(10) |
б) в нейтральной и кислой средах осуществляется процесс электрохимического окисления воды:
2H2O – 4ē = О2o + Н+; |
(11) |
в) кислородсодержащие анионы кислот не способны окисляться на электроде при электролизе или их окисление происходит при очень высоких значениях электродных потенциалов:
2SO4 |
2- – 2ē = S2O82-. |
(12) |
11
Стандартный потенциал данного процесса равен 2,01 В, что значительно превышает стандартный потенциал окисления воды 1,23 В;
г) при электролизе водных бескислородных кислот и их солей (кроме фтора и фторидов) у анода разряжаются только их анионы:
2I- − 2ē = I2°. |
(13) |
2. При электролизе соляной кислоты и ее солей на аноде возможно протекание следующих процессов:
2Cl- – 2ē = Cl2°; |
(14) |
2H2O – 4ē = О2° + 4Н+. |
(15) |
Стандартный потенциал окисления хлора равен 1,36 В; потенциал окисления воды – 1,23 В. Согласно правилам на аноде должен осуществляться процесс с меньшим значением электродного потенциала, однако на аноде идет выделение хлора. Эта аномалия связана со значительным перенапряжением второго из этих двух электродных процессов, поскольку материал анода оказывает тормозящее действие на процесс выделения кислорода.
3. В случае активного анода число конкурирующих окислительных процессов возрастает до трех:
а) электрохимическое окисление воды с выделением кислорода; б) разряд аниона (т. е. его окисление);
в) электрохимическое окисление металла анода (так называемое анодное растворение металла).
Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем (а, б), то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
1.6. Реальные электрохимические процессы. Явление поляризации
Литература: [4, § 56 – 57; 8, § 8.6].
Реальные электрохимические процессы существенно отличаются от равновесных, поскольку проходящий электрический ток вызывает изменения в рассматриваемых системах.
12
Изменение электродного потенциала при прохождении тока называется поляризацией:
∆Ε = φi – φp, |
(16) |
где ∆Ε – поляризация;
φi – потенциал электрода при прохождении электрического тока; φp – равновесный потенциал.
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном пространстве при прохождении тока называется концентрационной поляризацией.
Изменение концентрации реагирующих веществ в приэлектродном слое вызывается замедленностью подвода реагентов к электроду или отвода продуктов реакции от электрода.
Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией.
Поляризацию можно осуществить включением электрода в цепь постоянного тока. С этой целью составляют электролитическую ячейку из электролита и двух электродов – исследуемого и вспомогательного, причем исследуемый электрод можно сделать катодом и при обратном подключении – анодом. Такой способ поляризации называется поляризацией от внешнего источника тока.
Поскольку явление изменения потенциала электрода при прохождении тока может наблюдаться на аноде и катоде, то различают анодную и катодную поляризацию. Например, медный электрод находится в растворе сульфата меди. Пока цепь не замкнута, на границе раздела фаз устанавливается равновесие:
Сu – 2ē = Сu2+ . |
(17) |
Подключим электрод к отрицательному полюсу источника тока, следовательно, он становится катодом. Избыток электронов, который появляется на электроде, сдвинет потенциал электрода в отрицательную сторону, равновесие нарушится. Электроны будут притягивать катионы меди из раствора – происходит процесс восстановления. Если подключить электрод к положительному полюсу, он становится анодом. Вследствие удаления части электронов потен-
13
циал электрода сместится в положительную сторону – равновесие нарушится. Поскольку электроны будут освобождаться, то будет происходить процесс окисления. Следовательно, поляризация электрода в отрицательную сторону связана с протеканием процесса восстановления, поляризация в положительную сторону – с протеканием процесса окисления.
Таким образом, поляризация в отрицательную сторону называется катодной поляризацией, в положительную – анодной.
Значение поляризации, необходимое для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса.
Согласно закону Фарадея сила тока пропорциональна количеству вещества, прореагировавшего на электроде в единицу времени, т. е. скорости данной электрохимической реакции. Следовательно, сила тока может быть использована для количественной характеристики скорости электрохимической реакции. Однако электроды могут иметь разную площадь, тогда при одном и том же потенциале могут быть разные токи, поэтому скорость электрохимической реакции относят к единице площади поверхности.
Отношение силы тока к площади электрода называется плотностью тока:
i = I / S. |
(18) |
Для экспериментального определения значения поляризации строят графическую зависимость потенциала от плотности тока, которую называют поляризационной кривой.
Поляризационные кривые двух электродов представлены на рис. 1. Значение поляризации электрода определяют по формуле: ∆Ε = φi – φp. При некоторой плотности тока iх поляризация первого электрода равна ∆Εi1, второго соответственно – ∆Εi2. При одной и той же плотности тока поляризация первого электрода больше, чем второго: ∆Εi1 > ∆Εi2 , для получения большего значения силы тока необходимо большее отклонение потенциала от его равновесного значения. Таким образом, скорость электрохимической реакции может быть увеличена повышением поляризации; поляризация одного и того же электрода тем выше, чем больше плотность тока.
14
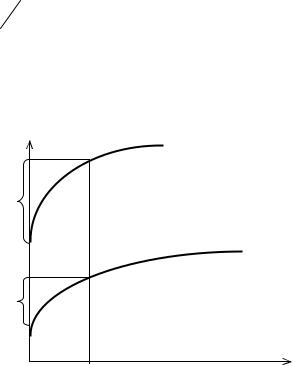
Поляризация электродов влияет на потенциалы выделения на них ионов. Особенно сильно это влияние на поведение иона водорода в водных растворах, известно, что ϕ0 2H+ H02 = 0, однако для начала выделения водорода в виде пу-
зырьков газа в ряде случаев требуется значительно большее напряжение, также зависящее от плотности тока j.
φ
1
φi1
2
∆Ε1 φp1
φi2
∆Ε2
φp2
iх |
I |
Рис. 1. Поляризационные кривые двух электродов
Перенапряжением называется превышение потенциала разрядки ионов над нормальным потенциалом в равновесных условиях.
Для водорода зависимость перенапряжения от плотности тока хорошо передается уравнением Тафеля:
η=a + blg j, |
(19) |
где а и b – константы, свойственные данному электроду.
Значения перенапряжения для водорода и кислорода на некоторых электродах (В. А. Киреев) приведены в табл. 1. Зная значение перенапряжения для водорода, можно регулировать режим электролиза (концентрация иона, рН, плотность тока и температура), что позволит выделять из водных растворов такие металлы, как железо, никель и даже цинк.
15
Таблица 1
Приближенные значения перенапряжения для водорода и кислорода на некоторых электродах
Металл электрода |
Значение перенапряжения η |
||
|
|
||
для водорода |
для кислорода |
||
|
|||
|
|
|
|
Pt (платинированная) |
0 |
0,25 |
|
Fe |
0,08 |
0,25 |
|
Pt (гладкая) |
0,09 |
0,45 |
|
Ag |
0,15 |
0,41 |
|
Ni |
0,21 |
0,06 |
|
Cu |
0,23 |
− |
|
Sn |
0,53 |
− |
|
Pb |
0,64 |
0,31 |
|
Zn |
0,7 |
− |
|
Hg |
0,78 |
− |
|
|
|
|
|
Таким образом, практическое применение электрохимических процессов должно учитывать кинетику процессов, так как в реальных условиях скорость растворения или выделения металла, определяемая плотностью тока, может существенно изменять результаты процесса.
1.7. Электролиз растворов
Литература: [1, § 57].
Электролиз является эффективным способом осуществления процессов окисления и восстановления. Если на аноде образуется кислород или хлор, то такое электролитическое окисление может применяться для окисления и хлорирования находящихся в растворе неорганических веществ, которые являются анодными (в данном случае) деполяризаторами. Если на катоде образуется водород, то такое электролитическое восстановление может применяться для гидрирования находящихся в растворе веществ, являющихся в таких процессах катодными деполяризаторами.
16
Наиболее важными техническими процессами электролиза являются процессы, связанные с осаждением металлов. Одновременное выделение нескольких металлов возможно, если подобран такой раствор электролита, в котором электродные потенциалы выделения этих металлов были бы близки.
Многие металлы (калий, натрий, магний и т. д.) получают электролизом расплава. Разнообразны и сложны процессы, проходящие в растворе соответствующих электролитов. В частности, при электролизе растворов на катоде может идти совместное выделение водорода и металла (при близких значениях электродных потенциалов). Однако, изменяя условия электролиза (плотность тока, температура, концентрация и состав электролита и т. д.), в технологическом процессе можно добиться выделения одного из веществ.
Рассмотрим несколько типичных случаев электролиза водных растворов.
Пример 2. Электролиз раствора КCl (графитовые электроды).
Наэлектродахмогутосуществляться следующие конкурирующиепроцессы:
К-: 1) К+ + ē = Ко; φ = –2,92 В; |
2) 2H2O + 2ē = H2о + 2OH-; φ = –0,41 В; |
А+: 3) 2Cl- – 2ē = Cl2о; φ = 1,36 В; |
4) 2H2O – 4ē = О2o + 4Н+; φ = 1,23 В. |
Согласно примечаниям, приведенным в подразд. 1.4, 1.5, на катоде будет происходить разряд ионов водорода, у катода будет образовываться гидроксид калия; на аноде будут разряжаться хлорид ионы.
Суммарное уравнение реакции можно записать следующим образом: |
|
2КCl + 2Н2О = Н2 + 2КОН + Cl2. |
(20) |
Пример 3. Электролиз хлорида олова SnCl2 (графитовые электроды). Наэлектродахмогутосуществляться следующие конкурирующиепроцессы:
К-: 1) Sn2+ + 2ē = Sno; φ = –0,14 В; 2) 2H2O + 2ē = H2о + 2OH-; φ = –0,41 В; А+: 3) 2Cl- – 2ē = Cl2о; φ = 1,36 В; 4) 2H2O – 4ē = О2o + 4Н+; φ = 1,23 В.
17
Согласно примечаниям, приведенным в подразд. 1.4, 1.5, на катоде выделяется олово, на аноде – хлор.
Суммарное уравнение электролиза раствора хлорида олова можно представить следующим образом:
SnCl2 = Sno + Cl2о. |
(21) |
Пример 5. Электролиз раствора сульфата меди (медный анод). Аналогично (см. пример 3) на катоде выделяется металлическая
медь, на аноде будет идти электрохимическое окисление материала анода (см. подразд. 1.5):
К-: Cu2+ + 2ē = Cuo; |
А+: Cuo – 2ē = Cu2+. |
(22) |
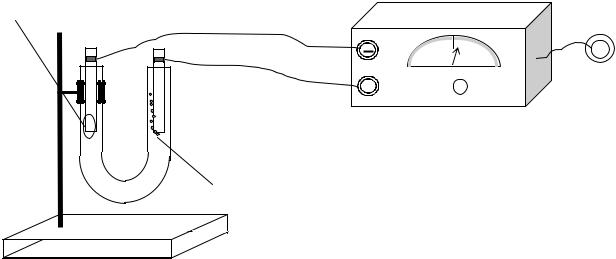
Пример 4. Электролиз раствора сульфата меди (графитовые электроды) (рис. 2).
На электродах могут осуществляться следующие конкурирующие процессы:
К-: 1) Cu2+ + 2ē = Cuo; φ = 0,34 В; 2) 2H2O + 2ē = H2о + 2OH-; φ = –0,41 В;
А+: 3) 2SO42- – 2ē = S2O42-; φ = 2,01 В; 4) 2H2O – 4ē = О2o + 4Н+; φ = 1,23 В.
Осадок выделяется
+
Пузырьки газа
Рис. 2. Лабораторный электролизер
18
Таким образом, (см. подразд. 1.4, 1.5) на катоде будут разряжаться ионы меди и выделяться металлическая медь; на аноде будет выделяться кислород, причем у анода образуется серная кислота:
2CuSO4 + 2Н2О = 2Cuo + О2o + 2H2 SO4. |
(23) |
Уравнения:
К-: |
Cu2+ + 2ē = Cu0 |
4 |
2 |
|
А+: 2H2O – 4ē = 2O2 + 4H+ |
2 |
1 |
|
|
|
|
|
|
|
|
|
|
||
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+ |
|
|
||
2CuSO4 + 2H2O = 2Cu + O2 + 4H2SO4 |
(24) |
|||
1. 8. Законы электролиза
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит электричества выражается законами Майкла Фарадея.
Первый закон. Массы веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего
через электролит: |
|
m = kIt; k = mэ/F, |
(25) |
где m – масса вещества, подвергшегося превращению или образовавшегося на электроде, г ;
mэ – эквивалентная масса вещества, г/моль; I – сила тока, А;
t – время, с;
F = 96500 – число Фарадея, Кл/моль.
Масса вещества, выделяющегося при прохождении одного кулона, называется электрохимическим эквивалентом (k).
19

Второй закон. При определенном количестве прошедшего электричества отношение масс прореагировавших веществ равно отношению их химических эквивалентов:
m1/m2 = mэ1/mэ2. |
(26) |
Выход по току – это отношение количества вещества, практически полученного на электродах, к теоретически рассчитанному по закону Фарадея:
η = mпр/mтеор 100%. |
(27) |
На законах Фарадея основаны расчеты, связанные с электрохимическими производствами. Этот закон может использоваться также для определения эквивалентных масс различных веществ.
2. УПРАЖНЕНИЯ ДЛЯ САМОКОНТРОЛЯ
Литература: [2, гл.VIII, § 7; 5, § 47].
Пример 6. Вычисление стандартной ЭДС поляризации. Вычислите стандартную ЭДС поляризации при электролизе водного раствора NaF с платиновым анодом.
Решение. На катоде выделяется водород. Катодный процесс описывается уравнением: 2H2O + 2e- = H2 +2OH-. Потенциал выделения водорода равен −0,82 В. Стандартный окислительно-восстановительный потенциал фтора − 2,85 В. При электролизе существенную роль играет поляризация электродов. При пропускании электрического тока через раствор электролита на электродах образуются окисли- тельно-восстановительные пары: на катоде − 2H2O/H2 + 2OH-, на аноде − F2/2F-. Эти окислительно-восстановительные пары являются полуэлементами гальванического элемента:
(–) H2; 2OH-/2H2O || 2F-/ F2 (+). |
(35) |
ЭДС этого гальванического элемента называется ЭДС поляризации и определяется по формуле:
Епол = ϕа – ϕк, |
(36) |
где ϕа и ϕк – потенциалы анода и катода.
20
