
Водно-химический режим АЭС с реакторами ВВЭР-1000 и РБМК-1000 Рощектаев Б.М
. .pdf
Рис. 4.1. Область рН водных сред соляной кислоты и едкого натра при изменении их концентрации от 0 до 1 моль/л
Пунктирные линии шкалы рН означают, что рН водного раствора кислоты либо щелочи может варьироваться в большем интервале рН, чем 0÷14. В самом деле, предположим, что максимальные значения концентрации HCl и NaOH имеют значение не 1 моль/л, а 3 моль/л, тогда рН таких растворов приобретут значения –0,5 и 14,5 соответственно, в чем легко убедиться.
В аналитической практике отрицательными значениями рН, так же как и значениями большими, чем 14, не пользуются по нескольким причинам. Во-первых, в концентрированном растворе измерять рН с помощью рН-метра не желательно, так как ошибка измерений в силу аппаратурных способностей рН-метра возрастает. Во-вторых, показания рН-метра будут характеризовать не концентрацию Н+ и ОН–, а их активность.
4.1. Расчет рН водных растворов
Можно рассчитать рН водных растворов кислот и оснований, если известны концентрации и константы диссоциации в случае слабых электролитов и, наоборот, зная рН, измеренный с помощью рН-метра, можно рассчитать концентрацию исходных продуктов:
Н 10 рН .
Для сильных кислот и оснований, в силу их полной диссоциации, рН растворов будет выражаться формулами:
рН lgСкислоты и рОН 14 lgСоснования .
81

4.2. Расчет рН слабых кислот и оснований
рН водных растворов слабых кислот и оснований нельзя рассчитать с помощью формул, полученных в конце предыдущего параграфа, поскольку они слабо диссоциируют на ионы, и концентрации Н+ и ОН– в силу этого не равны концентрациям исходных продуктов. Тем не менее, используя закон действующих масс применительно к слабой кислоте и слабому основанию, можно выразить зависимость концентраций Н+ и ОН– от констант диссоциации и концентраций исходных продуктов. А это означает, что можно найти формулы расчета рН. Первоначально получим формулу расчета рН слабой кислоты, например уксусной СН3СООН.
В соответствии с законом действующих масс константа диссоциации СН3СООН запишется следующим образом:
СН СООН СН СОО Н ;
3 |
|
СН |
3 |
|
|
Кд |
СОО Н |
|
|
|
3 |
|
. |
|
|
СН3СООН |
|||
|
|
|
||
Учитывая тот факт, что при диссоциации СН3СООН образуются равные количества ионов СН3СОО− и Н+, уравнение для константы
диссоциации можно переписать следующим образом: |
|||||||||
Кд |
|
|
Н 2 |
|
; |
|
|||
СН3СООН |
|
||||||||
Н 2 |
|
|
|
|
|||||
К |
д |
СН |
СООН ; |
||||||
Н |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
. |
||||
|
К |
д |
СН |
СООН |
|||||
|
|
|
|
3 |
|
|
|
|
|
Логарифмируя полученное уравнение с обратным знаком, имеем:
lg Н lg
 Кд СН3СООН , а поскольку −lg[Н+] = рН, то
Кд СН3СООН , а поскольку −lg[Н+] = рН, то
рН lg Н lg
 Кд СН3СООН ;
Кд СН3СООН ;
рН 12 lgКд 12 lg СН3СООН 12 рКд 12 lg СН3СООН .
Применительно к другим слабым одноосновным кислотам последнюю формулу можно представить в общем виде:
82

рН |
1 |
рК |
|
|
1 |
lgС |
|
, |
(4.6) |
|
кислоты |
|
кислоты |
||||||
|
2 |
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|||
где рКкислоты – константа.
Аналогично можно получить формулу расчета рН для слабого основания:
рН 14 |
1 |
рК |
|
|
1 |
lgС |
|
, |
(4.7) |
|
осн |
|
осн |
||||||
|
2 |
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|||
где рКосн – константа диссоциации основания.
4.3. Расчет гидролизующихся солей
Практика показывает, что рН водного раствора может изменяться не только в случае добавления к воде кислот либо оснований, но и в случае добавления гидролизующихся солей, которые образуются сильным основанием и слабой кислотой, слабым основанием и сильной кислотой, а также слабым основанием и слабой кислотой. Последние незначительно влияют на рН растворов и вследствие этого они опущены при дальнейшем рассмотрении.
Для объяснения влияния солей на рН растворов и вычисления рН необходимо воспользоваться уравнением гидролиза. Рассмотрим в качестве примера соль, образованную сильным основанием и слабой кислотой – ацетат натрия СН3СООNa.
Ацетат натрия в воде гидролизуется и рН раствора вследствие высвобождающихся ионов гидроксила повышается.
CH3COONa H2O CH3COOH NaOH .
В ионном виде:
CH3COO H2O CH3COOH OH .
рН такого раствора можно рассчитать, если воспользоваться формулой :
рН 7 |
1 |
рК |
|
|
1 |
lgС |
|
, |
(4.8) |
|
кислоты |
|
соли |
||||||
|
2 |
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|||
Изучающим вышеизложенный материал предлагается формулы (4.8), (4.9) вывести самостоятельно.
83
где Ккислоты и Ссоли – константа диссоциации кислоты и концентрация соли.
При гидролизе соли, образованной слабым основанием и сильной кислотой, например, NH4Cl, возрастает концентрация ионов водорода и рН раствора понижается.
NH4Cl H2O NH4OH HCl .
В ионном виде:
NH4 H2O NH4OH H .
Формула нахождения рН:
рН 7 |
1 |
рК |
|
|
1 |
lgС |
|
, |
(4.9) |
|
осн |
|
соли |
||||||
|
2 |
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|||
где Косн и Ссоли – константа диссоциации кислоты и концентрация соли.
4.4. Буферные растворы
На практике очень часто имеют дело с растворами, содержащими одновременно слабую кислоту и ее соль или же слабое основание и его соль. Такие системы называются буферными. Их отличие от обычных систем заключается в том, что при добавлении к ним кислот либо оснований рН буферных систем практически не меняется. Не меняется рН и в том случае, если буферные системы развести чистой водой или же пропорционально увеличить концентрацию исходных продуктов.
Для объяснения вышеуказанного и нахождения рН рассмотрим буферную смесь, состоящую из слабого основания и его соли. Возьмем для примера аммиачную буферную смесь NH4OH и NH4Cl. Нетрудно заметить, что рН смеси будет определяться содержанием ионов ОН–, образующихся за счет диссоциации NH4OH, однако сам процесс диссоциации во многом зависит от присутствия соли NH4Cl (одноименного иона NH4+). Запишем уравнения диссоциации.
NH4ОН NH4 ОH ;
NH4Cl NH4 Cl .
Для нахождения рН воспользуемся уравнением, для которого справедливо
84

КNН4 OH .
дNH4ОН
Это равенство говорит о том, что если бы концентрация [NH4+] равнялась концентрации, полученной только за счет диссоциации NH4OH, то рассматриваемый случай свелся бы к определению рН слабого основания. В случае, когда концентрация ионов NH4+, в основном, определяется концентрацией ионов NH4+, полученных за счет полной диссоциации соли, концентрацией ионов NH4+, полученных за счет диссоциации слабого основания NH4OH, можно пренебречь в виду их малого количества. Принимая во внимание вышесказанное, уравнение для константы диссоциации можно представить в виде:
КNН4Cl OH ,
дNH4ОН
откуда |
|
|
NН4OH ; lg OН lgК |
|
|
NН4OH |
|
||||||
OН К |
|
|
|
|
; |
||||||||
|
д |
|
NН |
Cl |
|
|
|
д |
|
NН |
Cl |
|
|
|
|
|
4 |
|
NН4OH |
|
|
|
|
4 |
|
|
|
|
|
|
рОН рКд lg |
; |
|
|
|
|
|
|
|||
|
|
|
NН4Cl |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
pH 14 рОН 14 рКд lg |
NН4OH |
. |
|
|
|||||||||
NН4Cl |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||
В общем виде последнее выражение можно записать
следующим образом: |
|
|
|
|
|
pH 14 рК |
|
lg |
Сосн |
. |
(4.10) |
осн |
|
||||
|
|
Ссоли |
|
||
|
|
|
|
||
При равенстве Сосн = Ссоли выражение перепишется в виде: pH 14 рКосн .
Аналогичные рассуждения применимы и к буферным растворам, образованным слабой кислотой и ее солью. рН такой системы будет определяться выражением:
pH рК |
|
lg |
Скисл |
. |
(4.11) |
кисл |
|
||||
|
|
Ссоли |
|
||
|
|
|
|
||
При равенстве Скисл = Ссоли имеем:
85
pH рКкисл .
Полученные формулы для определения рН показывают, что рН буферных систем не изменится, если концентрации исходных продуктов пропорционально увеличить либо уменьшить путем разбавления. Кроме того, рН мало изменится, если к ним добавить сильную кислоту либо сильную щелочь. В этом случае система нейтрализует сильную кислоту или щелочь, переводя их либо в слабые кислоту и щелочь, либо в их соли.
Представленные формулы расчета рН позволяют персоналу химлабораторий АЭС рассчитывать необходимые количества химических реагентов, которые требуются для приготовления больших количеств водных растворов кислот и щелочей для поддержания показателей рН при проведении кислотных и щелочных промывок реакторного оборудования, дезактивации и водно-химических режимов энергоблоков.
5. ИОНООБМЕННЫЕ ФИЛЬТРЫ (СМОЛЫ) И ИХ ПРИМЕНЕНИЕ НА АЭС
Ионообменные смолы – это твердые, зернистые, механически прочные, химически устойчивые, нерастворимые вещества, способные к обмену ионов, содержащихся в воде, т.е. к тонкой очистке воды, необходимой для нужд АЭС.
Высокомолекулярные вещества, не растворимые в воде и способные к реакциям ионного обмена, называются ионитами. Иониты могут быть природными и синтетическими. Синтетические иониты получают искусственно, используя органические исходные вещества (например, стирол). В результате синтеза образуются гранулы (зерна) ионитов требуемых размеров (0,3 – 1,2 мм), состоящие из нерастворимой матричной части (сополимера) и привитых к ней соединений, способных к диссоциации в воде на ионы.
По методу получения синтетические иониты делятся на полимеризационные и поликонденсационные (табл. 5.1). Поликонденсационные иониты получают поликонденсацией соответствующих мономеров. Эту группу полимеров составляют различные типы фенолформальдегидных смол и иониты, образованные поликонденсацией эпихлоридгидринов или этиленхлорида с первичными и вторичными аминами. Главным
86

недостатком поликонденсационных матриц считают меньшую воспроизводимость их свойств и более низкую химическую устойчивость по сравнению с матрицами полистирольного типа.
Любой ионит представляет собой матрицу, содержащую способные к обмену ионогенные (функциональные) группы. Большинство современных синтетических органических ионитов имеет каркас из сополимера стирола с дивинилбензолом (ДВБ) – полимеризационные иониты. Эта эластичная трехмерная углеводородная матрица легко образуется и обладает достаточной химической и физической устойчивостью в различных условиях. Ионогенные группы могут быть легко присоединены к этому каркасу при соответствующих химических реакциях.
Методы получения сильнокислотного катионита КУ-2-8 и сильноосновного анионита АВ-17-8 представлены нижеследующими химическими реакциями:
Полученный сополимер представляет собой частицы правильной сферической формы размером 0,1 – 1,5 мм. Количество дивинилбензола в сополимере составляет 6 – 10 %. Он придает сополимеру достаточную механическую прочность и гидрофильность. Для придания сополимеру катионообменных свойств его сульфируют серной кислотой:
87
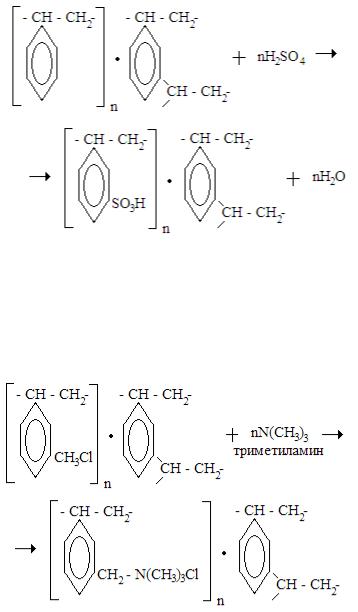
В результате сульфирования сополимера серной кислотой получают катионит марки КУ-2-8. Для получения катионита ядерного класса катионит тщательно отмывают от примесей, особенно от ионов хлора, тяжелых металлов. В маркировке особо чистых смол помимо обычных вводится поясняющее обозначение «чс», КУ-2-8 чс.
Сильноосновный анионит АВ-17-8 получают обработкой хлорсодержащего сополимера триметиламином:
Обозначив сополимер в первом и во втором случае через R, можно записать катионит КУ-2-8 и анионит АВ-17-8 как R-SO3H и
88
R-N(CH3)3Cl соответственно. При этом функциональная группа катионита запишется как -SO3H, а функциональная группа анионита запишется как -N(CH3)3Cl. Диссоциация катионита и анионита протекает по уравнениям:
R - SO 3H R - SO 3 Н ,
R - N(CH3 )3 Cl R - N(CH3 )3 Cl .
Технические характеристики ионообменной смолы КУ-2-8чс. Внешний вид – сферические зерна от желтого до темно-
коричневого цвета. Гранулометрический состав: размер зерен 0,4 – 1,25 мм, объемная доля рабочей фракции 96 %, эффективный размер зерен 0,45 – 0,65, коэффициент однородности не более 1,7, массовая доля влаги 50 – 60 %, удельный объем в Н-форме не более 2,7 см3/г, полная статическая обменная емкость 1,8 ммоль/см3, динамическая обменная емкость 1600 моль/см3, окисляемость фильтра в пересчете на О2 0,5 мг/г, осмотическая стабильность 96 %.
Технические характеристики ионообменной смолы АВ-17-8чс. Внешний вид – сферические зерна от желтого до темно-
коричневого цвета. Гранулометрический состав: размер зерен 0,315 мм, объемная доля рабочей фракции 95 %, эффективный размер зерен 0,4 – 0,6, коэффициент однородности не более 1,8, массовая доля влаги 35 – 50 %, удельный объем в ОН-форме не более 3,0 см3/г, полная статическая обменная емкость 1,15 ммоль/см3, динамическая обменная емкость 700 моль/см3, окисляемость фильтра в пересчете на О2 0,55 мг/г, осмотическая стабильность 92,5 %.
К полимеризационным ионитам относятся марки КУ-2-8, КУ-2-8 чс, АВ-17-8, АВ-17-8 чс. К поликонденсационным ионитам относятся марки АН-31, КУ-1, АВ-16 чс.
|
|
Таблица 5.1 |
|
Основная классификация ионитов |
|
Ионит |
Тип |
Ионогенные группы |
|
Сильнокислотный |
-SO3H (сульфоновые) |
Катионит |
Среднекислотный |
-PO(OH)2 (фосфоновые) |
|
Слабокислотный |
-СООН (карбоксильные) |
|
Сильноосновный |
-N+(CH3)3OH (тип 1) |
|
|
-N+(CH3)2С2H5ОНОН |
Анионит |
Среднеосновный |
(смесь третичных аминов и |
|
|
четвертичных аминогрупп) |
|
Слабоосновный |
Амины, полиамины |
89
Ионы, присутствующие в ионогенной группе и способные к обмену, носят название противоионов. Заряд противоионов компенсируется противоположнозаряженными фиксированными зарядами, которые связаны с матрицей ионита ковалентной связью. Противоион связан с макроионом электростатическими силами. Для указания вида иона, присоединенного к смоле, используют название соответствующего иона, за которым следует термин «форма». Символ RSO3H означает, что ионит находится в Н-форме и обменивает ион водорода. Через R обозначен каркас смолы. Каркасы ионитов имеют гелевую, макропористую, промежуточную структуру.
Гелевые (микросетчатые) иониты лишены истинной пористости и способны к ионному обмену только в набухшем состоянии. Макропористые (макросетчатые) обладают развитой поверхностью из-за наличия пор и поэтому способны к ионному обмену как в набухшем, так и в ненабухшем состоянии.
Гелевые иониты характеризуются большей обменной емкостью, чем макропористые, но уступают им по осмотической стабильности, химической и термической стойкости.
Иониты представлены анионитами – материалами, способными к обмену анионов; катионитами – материалами, обменивающимися катионами; амфолитами – в зависимости от условий могут обмениваться либо катионами, либо анионами.
Аниониты подразделяются на:
сильноосновные, способные к обмену анионов любой степени диссоциации в растворах при любых значениях рН;
слабоосновные, способные к обмену анионов из растворов кислот при рН 1 – 6;
промежуточной и смешанной активности.
Катиониты подразделяются на:
сильнокислотные, способные к обмену катионов в растворах при любых значениях рН;
среднекислотные, обменивающие катионы в щелочных средах при рН > 7.
Процессы ионного обмена подчиняются трем основным закономерностям: эквивалентности, т.е. соблюдению определенных массовых соотношений между реагирующими веществами (стехиометрических отношений); обратимости процессов; преимущественной адсорбции одних ионов по сравнению с другими, т.е. селективности.
90
