
Тема 4. Химическая связь и строение молекул.
Атомы являются простыми частицами, не существующими самостоятельно.
Атомы объединяются в более сложные частицы:
молекулы(С3, Н8, О3),
радикалы (С2Н5-),
ионы (NН4+).
Те силы и механизмы, которые заставляют атомы объединяться в сложные частицы, называют химической связью. От типа химической связи зависит основные свойства вещества.
Электропроводность:
|
Сu |
NaCl |
C12H22O11 |
|
в любом виде проводит ток |
в жидком виде проводит ток |
не проводит ток |
Ионная связь
Ионная связь объясняется следующим образом: атом - типичный металл - теряет свой валентный электрон, превращаясь в катион.
Атом – типичный неметалл - принимает электрон, превращаясь в анион.
Na0
–
![]() =
Na+
(катион)
Cl0
+
=
Na+
(катион)
Cl0
+
![]() =
Cl--
(анион)
=
Cl--
(анион)
Ионная связь является максимально полярной. Она образуется атомами тех элементов, которые имеют максимально различные электроотрицательности, т. е. ионная связь образуется щелочными и щелочно-земельными металлами и галогенами:
KF; CaCl2; NaI.
Ионная связь имеет два основных свойства:
ненаправленность,
ненасыщаемость.
Эти два свойства тесно связанны между собой.
Два иона: катион и анион полностью не могут компенсировать силовые поля друг друга, поэтому для компенсации своих зарядов каждый ион вынуждает притягивать из пространства дополнительные ионы противоположного знака.
В этом заключается ненасыщаемость.
Так как электрическое поле иона имеет сферический характер, то для ионной связи характерна ненаправленность.
Благодаря тому, что энергия ионизации больше энергии сродства к электрону, полного перехода электронов не происходит даже в случае атомов с очень большой разностью электроотрицательности. Таким образом, соединений с чисто ионной связью не существует. Можно говорить лишь о доле ионной связи.
В силу особенностей ионной связи, т.е. её полярности, ненаправленности и ненасыщаемости, молекулы с ионной связью являются достаточно относительным понятием.
В водных растворах и расплавах ионные молекулы полностью диссоциированы на ионы:
AB=A++B-.
Двух- и трёхионных соединений не существует, а весь кристалл ионного соединения можно рассматривать как молекулу, состоящую из огромного числа ионов:
AmBn .
Ковалентная связь
Ковалентная связь является наиболее универсальной в том плане, что ей подчиняется подавляющее большинство веществ как органических, так и неорганических.
Суть ковалентной связи по методу валентных связей (ВС) заключается в том, что атомы, объединяя свои неспаренные валентные электроны с антипараллельными спинами в общую электронную пару, образуют более сложную частицу.
 .
.
Электронную пару по методу ВС обозначают двумя точками или чёрточкой - валентным штрихом.
Ковалентная связь имеет пять основных свойств:
1. Энергия связи – выделенная атомами потенциальная энергия при образовании ими более сложных частиц.
При сближении двух атомов водорода максимально выделяется 435 кДж/моль. Это и является энергией молекулы водорода. Такой энергии соответствует максимально прочная молекула водорода. Энергия ковалентной связи лежит в пределах 150 ÷ 1000 кДж/моль. Чем выше энергия, тем прочнее частица.
![]() =
150 кДж/моль
=
150 кДж/моль![]() =
435 кДж/моль
=
435 кДж/моль![]() =
970 кДж/моль.
=
970 кДж/моль.
2. Длина связи – расстояние между центрами двух атомов, которое соответствует максимально потерянной потенциальной энергии, и сложная частица является наиболее прочной. Таким образом, длина связи тесно связана с энергией.
Для
атома водорода длина связи составляет
0,74
![]() .
.
![]()
Это означает, что два атома Н2 не просто соприкасаются, а частично перекрывают друг друга.

Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
3. Полярность
Ковалентные частицы могут быть полярными и неполярными. Полярная ковалентная связь возникает в том случае, если частица образованна атомами с различными электроотрицательностями.
|
|
+1 -1 |
|
HF |
|
|
ЭО (Н) = 2,1 |
+1 -1 |
|
ЭО (F) = 4 |
H : F |
В молекуле возникают два поля – диполи (+ ; -), между которыми есть какое-то расстояние. Диполь определяется дипольным моментом, который равен заряду электрона, умноженному на дипольное расстояние
μ = е • l
Размерность дипольного момента Кулон/метр (Кл/м).
Чем больше разница между электроотрицательностью элементов, тем больше дипольный момент сложной частицы, т.е. тем полярней диполь.
Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковой электроотрицательностью.
В ковалентных неполярных частицах общая электронная пара принадлежит одинаково ядрам обоих атомов.
![]() расстояние
между "+" и "–" равно нулю.
расстояние
между "+" и "–" равно нулю.
Дипольный момент тоже равен нулю.
Полярность связи и полярность частиц не всегда совпадают между собой.
|
|
|
|
Полярность – векторная величина. Вектор всегда направлен от менее электроотрицательных элементов к более электроотрицательным элементам.
В молекуле СО2 два вектора, равные по величине, но противоположные по направлению, компенсируют друг друга, и молекула оказывается неполярной при полярной связи.
4. Насыщаемость ковалентной связи заключается в том, что все неспаренные валентные электроны обязаны участвовать в образовании сложных частиц.
Электроны обладают способностью самопроизвольно перераспределяться по подуровням в пределах одного энергетического уровня (без изменения главного квантового числа).

Из
четырёх валентных электронов неспаренными
являются два и
![]() валентность
углерода в данном случае равна двум.
валентность
углерода в данном случае равна двум.

Теперь
все четыре валентных электрона распарены,
![]() и
валентность углерода равна четырем.
и
валентность углерода равна четырем.
5. Направлентность ковалентной связи заключается в том, что ковалентные частицы имеют определённую пространственную конфигурацию.
Пространственная конфигурация отдельной частицы определяется количеством σ – связей и их взаимным расположением в пространстве.
σ- связями называются связи, у которых область повышенной электрической плотности располагается на линии, связывающей ядра двух атомов.
σ – связь - это первичная связь. Она является прочной и трудно разрывается.
π – связью называется та связь, при которой обе повышенные электрические плотности располагаются выше и ниже линии, связывающей ядра двух атомов.
π – связь всегда вторична и менее прочна, чем σ – связь.
При образовании молекулы водорода перекрываются 2S – облака, и образуется одна σ – связь.
Возникает линейная молекула с нулевым валентным углом.

Такие же частицы, т.е. линейные с нулевым валентным углом, образуются при перекрывании двух рх – облаков, при образовании, например, молекул хлора или фтора.
Такие же частицы образуются при перекрывании S- и p-облаков (например, HCl).
Рассмотрим элемент шестой группы таблицы Менделеева - кислород.
 .
.
Кислород является центральным атомом в молекуле воды.
Из шести валентных электронов атомов кислорода - два неспаренных. в пространстве возникают две σ–связи, расположенные друг к другу под теоретическим углом 90°.
В молекуле воды угол равен 105°, но это вызывается дополнительными причинами.
Азот, элемент пятой группы таблицы, имеет следующее валентное окончание:
 .
.
Атом азота имеет три неспаренных электрона, которые участвовуют в образовании частиц, например, NH3.
Три σ – связи, расположенные под углом 90° по отношению друг к другу, приводят к образованию молекулы, имеющей форму треугольной пирамиды с валентными углами 90° (рисунок).
Углерод, элемент четвёртой группы таблицы, в возбуждённом состоянии имеет четыре неспаренных электрона и проявляет валентность, равную четырём
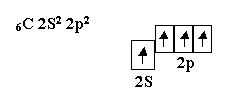 .
.
Электроны, находящиеся в S- и в p-состояниях, не равноценны между собой, так как имеют разную конфигурацию и различный запас потенциальной энергии. Чтобы образовать равноценные связи, эти электроны должны гибридизироваться.
Гибридизация электронов происходит по форме и энергии. S- и р – облака образуют гибридные q – облака, имеющие конфигурацию
 .
.
|
|
В атоме углерода происходит SP3 – гибридизация, которая приводит к образованию четырёх гибридных q – электронов:
SP3
Четыре равноценных q – электрона образуют четыре равноценные σ – связи, например, в молекуле метана CH4. Такие молекулы (CH4, CCl4 и т.д.) имеют пространственную конфигурацию - тетраэдр с валентными углами 109°28'.
|
Бор, элемент третьей группы таблицы Менделеева, имеет валентное окончание:
 .
.
В молекуле BCl3 все три связи должны быть образованы равноценными электродами, поэтому валентные электроны атома бора подвергаются гибридизации. В данном случае, SP2 -гибридизации, в результате которой образуются три гибридных q-электрона.
|
|
SP2
Молекула BCl3 имеет в пространстве конфигурацию плоского треугольника с валентными углами 120°. |
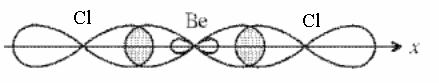
Элемент второй группы, бериллий, образует сложные частицы только в возбуждённом состоянии:
 .
.
|
|
Валентные электроны атома бериллия подвергаются Sp – гибридизации, в результате которой образуется два гибридных q – электрона.
SP Два гибридных q – электрона, перекрываясь, образуют две σ – связи. |
В результате образуется линейная молекула с валентным углом 180°.
Пространственная конфигурации частиц
|
N группы |
Валентный электрон |
Конфигурация частиц |
Валентный угол |
Пример частицы |
|
1 |
S1 |
линейная |
0° |
Н2 |
|
2 |
q2 |
линейная |
180° |
BeCl2 |
|
3 |
q3 |
плоский треугольник |
120° |
BCl3 |
|
4 |
q4 |
тетраэдр |
109°28' |
CH4 |
|
5 |
p3 |
треугольная пирамида |
90° |
NH3 |
|
6 |
p2 |
угловая |
90° |
H2Se |
|
7 |
p1 |
линейная |
0° |
Cl2, F2 |
Донорно – акцепторный механизм ковалентной связи
|
NH4+ |
H3O+ |
|
ион аммония |
ион гидроксония |
|
NH3 + H+ = NH4+ |
H2O + H+= H3O+ |
Ион водорода – атом Н, потерявший свой единственный электрон и имеющий свободную орбиталь.
|
H0
– e
|
|
На связь с водородом идет 3 электрона атома азота
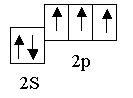
Неподелённая электронная пара азота самопроизвольно, с энергетическим выигрышем, занимает свободную орбиталь иона водорода.
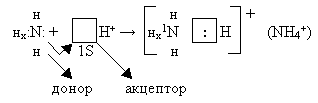 .
.
Атом азота, имеющий неподелённую электронную пару, называется донором.
Частица принимающая электронную пару на свою свободную орбиталь, называется акцептором.
Отсюда - донорно – акцепторная связь.
В случае донорно – акцепторной связи две частицы соединяются в одну при помощи электронной пары (также как в ковалентной связи по методу валентных связей).
При возникновении донорно-акцепторной связи частицы не имеют неспаренных валентных электронов. В данном случае одна частица имеет неподелённую электронную пару, а другая - свободную орбиталь. Это отличает донорно- акцепторный механизм от ковалентной связи по методу валентных связей.
Понятие ковалентной связи объяснило образование, строение и свойства очень многих веществ, органических и неорганических.
Но ковалентная связь не смогла объяснить образование сложных частиц, имеющих нечётное колличество валентных электронов; существование таких частиц, как молекулярные ионы. А также ковалентная связь по методу ВС не объяснила парамагнитные и диамагнитные свойства веществ.
Для ответа на все эти вопросы в середине двадцатого века был разработан метод молекулярных орбиталей, трактующий механизм ковалентной связи.
По методу молекулярных орбиталей любая молекула рассматривается как совокупность всех ядер и электронов всех атомов, образующих данную сложную частицу.
Существует несколько вариантов этого метода. Рассмотрим один из них, наиболее распространённый.
ЛКАО МО – линейная комбинация атомных орбиталей - есть молекулярная орбиталь.
Образование её можно представить как результат сложения и вычитания комбинируемых атомных орбиталей.
Если атомные орбитали обозначить φA и φB, то их линейная комбинация даст молекулярные орбитали двух типов. При сложении возникает молекулярная орбиталь ψ+, при вычитании - ψ-.
Сложение означает, что молекулярная орбиталь характеризуется повышенной электронной плотностью в пространстве между ядрами, поэтому энегетически она выгоднее исходных атомных орбиталей. Такая орбиталь называется связующей.
При вычитании атомных орбиталей образуется орбиталь с пространственным разрывом между ядрами. Электронная плотность равна нулю, и подобная орбиталь энергетически менее выгодна, чем исходные атомные орбитали. Такая молекулярная орбиталь называется разрыхляющей.
Молекулярные орбитали дополняются электронами по тем же законам,что и атомные - согласно принципу наименьшей энергии и запрету Паули.
Молекулярные орбитали располагаются по уровню энергии в следующем порядке:
σсв 1S < σразр 1S < σсв 2S < σразр 2S < σсв 2Px < πсв 2Py= πсв 2PZ < πсв 2Py = πсв 2PZ < σсв 2Px
Ион водорода H2+ имеет один электрон, который займёт наиболее энергетически выгодную орбиталь σсв 1S.
Электронная формула данного иона:
σсв 1S1.
Молекула водорода H2 имеет два электрона и его электронная формула:
σсв 1S2.
Существует критерий, по которому определяют, образовалась ли прочная частица.
Этот критерий называют порядком связи.
Порядок связи (N) оценивается полуразностью связующих и разрыхляющих электронов
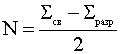 .
.
Чем выше порядок связи, тем прочнее ковалентная частица. Если порядок связи равен нулю, частица не существует.
Водородная связь
Атом водорода – самый маленький и самый легкий из всех существующий атомов. Имеет заряд +1. С наиболее электроотрицательными элементами (F, О, N) водород образует дополнительные связи, которые называют водородными.
Водородная связь возникает между водородом и кислородом, которые принадлежат к различным молекулам и ковалентно между собой не связаны.
Водородную связьобозначают точками.
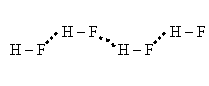
Водородная связь близка к межмолекулярным связям. Все межмолекулярные связи имеют низкую энергию.
Энергия водородной связи низкая: 8 ÷ 40 кДж/моль.
Наиболее высокая энергия водородной связи у водорода с фтором (25÷ 40 кДж/моль), ниже - с О (13÷ 29 кДж/моль) и еще ниже с N (8 ÷ 21 кДж/моль).
Водородная связь характерна для спиртов, карбоновых кислот, в том числе высших и нуклеиновых, белков, поэтому, несмотря на низкую энергию связи, водородная связь крайне важна для жизни на Земле.





