
Тема 2. Строение атомов элементов.
Запрет Паули
В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел.
Таким образом, запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней.
Электронная ёмкость уровней рассчитывается по формуле:
N = 2n2,
где N – число электронов на данном уровне,
n – главное квантовое число.
Принцип Хунда
На данном энергетическом подуровне электроны располагаются таким образом, чтобы их суммарный спин был максимальным.
|
7N |
|
1S2 2S2 2p3 |
|
|
|
ΣS = ± 1/2 · 3 = 1,5 |
Первое правило Клечковского
Электронами в первую очередь заполняются орбитали с меньшим значением суммы главного и орбитального чисел, а затем уже орбитали с большим значением суммы этих двух чисел.
|
|
Σ1(n + l) |
< Σ2(n + l) |
|
|
|
|
|
|
1S |
2S |
2p |
3S |
3p |
3d |
4S |
4p |
|
Σ(n+l) |
1 |
2 |
3 |
3 |
4 |
5 |
4 |
5 |
Согласно первому закону Клечковского, в первую очередь заполняются электронами nS-орбитали, а затем (n-1)d, которые имеют больший запас потенциальной энергии.
Например, сначала заполняются электронами орбитали 4S, а затем орбитали 3d.
|
18Ar…3S23p63d0 |
|
19K…3S23p63d04S1 |
|
20Ca…3S23p63d04S2 |
|
21Sc…3d14S2 |
Второе правило Клечковского
Если две орбитали имеют одинаковое значение суммы главного и орбитального чисел, то в первую очередь электронами заполняется та орбиталь, у которой главное квантовое число имеет меньшее значение.
Σ1(n + l ) = Σ2(n + l )
|
1S |
2S |
2p |
3S |
|
1 |
2 |
3 |
3 |
Из двух орбиталей с одинаковым значением сумма n и l (2p и 3S) в первую очередь принимает электроны орбиталь 2p.
Тема 3. Периодический закон химических элементов. Периодическая система.
Периодический закон химических элементов был сформулирован Д.И.Менделеевым в 1869 году.
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Современная формулировка Периодического закона: Строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов. Периодическая система – математическая интерпретация Периодического закона. Периодическая таблица – графическое изображение Периодической системы.
Периодическая таблица Менделеева
Таблица состоит из 7 периодов. Первые три периода малые, последние четыре периода большие.
Физический смысл номера периода заключается в том, что номер периода соответствует главному квантовому числу.
Формирование малых периодов
Ёмкость первого энергетического уровня равна двум электронам (N=2), следовательно, первый период состоит из двух элементов:
|
|
S-элементами называют элементы, у которых заполняются электронами S-подуровни. |
Ёмкость второго энергетического уровня N = 8. Длина второго периода составляет 8 элементов.

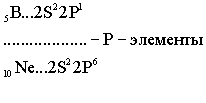
В силу первого правила Клечковского длина и строение третьего периода в точности повторяют второй: два S - элемента, шесть P - элементов.
Каждый период начинается с двух S – элементов, которые, за исключением водорода и гелия, являются самыми активными металлами.
Каждый период заканчивается активными неметаллами, за исключением благородных газов - химически инертых веществ.
Признаком металличности элементов является их способность терять свои валентные электроны.
|
Ме0 - е |
|
Ме+ |
реакция окисления |
|
восстановитель |
|
| |
Мера металличности элементов является мерой их восстановительной способности.
Металличность элементов имеет количественную характеристику - энергию ионизации
ЕI, эВ/ат.
Энергия ионизации – энергия, необходимая для отрыва электрона от атома.
Чем ниже эта энергия, тем более активным металлом является данный элемент.
Электрон
самопроизвольно отрывается от атома в
том случае, если Еj
![]() 40
эВ/ат.
40
эВ/ат.
Ионизационный потенциал также характеризует отрыв электрона от атома
UI B/ат.
Признаком неметалличности элементов является способность принимать электроны, т.е. окислительная способность.
|
Cl0 |
+ е |
|
Cl- реакция восстановления |
|
|
окислитель | ||
Количественной характеристикой неметаличности элементов является сродство к электрону – F эВ/ат.
Сродство к электрону – энергия, необходимая для отрыва принятого электрона.
Чем выше сродство к электрону, тем более сильным окислителем, т.е. неметаллом, является данный элемент.
Существует суммарная характеристика сродства к электрону и энергии ионизации. Это так называемая, относительная электроотрицательность элементов.
![]()
Относительная электроотрицательность показывает способность атомов притягивать к себе электроны при связывании с другими атомами.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
|
Элементы |
Z |
R,нм |
EI, эв/ат |
F, эв/ат |
Электроотрицательность (ЭО) |
|
Li |
3 |
0.55 |
5.39 |
|
1,0 |
|
F |
9 |
0.064 |
17.4 |
3.61 |
4.0 |
|
Na |
11 |
0.189 |
5.14 |
|
0.9 |
|
Cl |
17 |
0.099 |
12.07 |
3.45 |
3.0 |
|
Be |
4 |
0.113 |
9.32 |
|
1.5 |
|
Mg |
12 |
0.160 |
7.65 |
|
1.2 |
Электроотрицательность измеряется в относительных величинах. Наиболее электроотрицательным из всех элементов является фтор (F) - его электроотрицательность в шкале Полинга принята равной 4,0. Остальные элементы по сравнению с фтором имеют меньшую электроотрицательность .
Формирование больших периодов
Четвёртый период – первый большой период (18 элементов)



Пятый период. Длина и строение пятого периода в точности повторяет длину и строение четвёртого периода.
Шестой период.
|
55Cs |
6S1 |
|
56Ba |
6S2 |
|
57La |
5d16S2 |
Лантан принимает первый электрон на подуровень 5d, затем, в соответствии со вторым законом Клечковского, заполнение электронами подуровня 5d приостанавливается, и начинает заполнятся электронами подуровень 4f.
|
58Сe |
4S1 5S2 5p6 5d1 6S2 |
|
|
71Lu |
4f14 5S2 5p6 5d1 6S2 |
|
|
72Hf |
5d2 6S2 |
После заполния электронами подуровня 4f продолжается заполние подуровня 5d, снова появляются d-элементы. |
|
80Hg |
5d10 6S2 |
Заканчивается период шестью p-элементами. Таким образом, 6-й период имеет следующее строение:
S – элементы – 2 d – элементы – 1 f – элементы – 14 d – элементы – 9 p – элементы – 6 / Всего 32 элемента.
Седьмой период в точности повторяет длину и строение шестого периода. Все трансурановые элементы, начиная с 93Np, являются искусственными.
В больших периодах характер изменения свойств элементов тот же, что и в малых, только замедленный.
Все S – элементы, кроме Н и Не, - самые активные металлы. Все d и f – элементы тоже металлы. р – элементы частично металлы, частично неметаллы.
Группы таблицы Менделеева
Таблица Д.И. Менделеева состоит из 8 групп. Физический смысл номера группы заключается в том, что номер группы соответствует валентности входящих в него элементов.
Если элемент обладает переменной валентностью, то номер группы соответствует наивысшей валентности данного элемента.
Каждая группа делится на главную (А) и побочную (В) подгруппу. Главная подгруппа содержит элементы и малых, и больших периодов (S и p - элементы). Побочные подгруппы включают в себя d и f – элементы, т.е. элементы только больших периодов.
Элементы, составляющие одну подгруппу, имеют близкие химические свойства, т.к. имеют сходные валентные окончания. Химические свойства элементов обуславливаются их валентными окончаниями.
Валентное окончание элемента зависит от его положения в таблице Менделеева.
Все элементы одной подгруппы имеют одинаковую конфигурацию валентных окончаний, но разные квантовые числа.
С увеличением главного квантового числа у элементов данной подгруппы усиливаются металлические свойства, что обусловлено, в первую очередь, увеличением промежуточных электронных слоёв между ядром атома и его валентным слоем.
Элементы, составляющие одну группу, но разные подгруппы, имеют различные валентные окончания и различные химические свойства.
|
17Cl |
3S23p5 |
25Mn |
3d54S1 |
|
активный неметалл |
металл средней активности | ||
Элементы, составляющие одну группу, имеют одинаковую валентность. В случае переменности валентности общей является наивысшая валентность.
|
1, 3, 5, 7 |
2, 3, 4, 5,6, 7 |
|
+7 |
+7 |
|
HClO4 |
HMnO4 |
|
хлорная кислота |
марганцовая кислота |
Следующие свойства элементов являются периодическими:
металличность и связанная с ней восстановительная способность;
энергия ионизации;
неметалличность и связанная с ней окислительная способность;
сродство к электрону;
электроотрицательность;
атомные радиусы.
Свойства, не имеющие периодичности :
заряд ядра;
атомная масса.
Периодический характер изменения имеют не только элементы, но и их соединения. Оксиды элементов, расположенных в начале периодов ( Li2O; Na2O; MgO), имеют основный характер. Затем идут амфотерные оксиды (BeO, Al2O3). Элементы, расположенные во второй половине, имеют кислотный характер (CO2, NO2, SiO2).

