
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf
2.4. Радикальные реакции |
141 |
ставлена такая диаграмма, показывающая, что энергия образования изопропильного радикала заметно ниже, чем энергия образования пропильного радикала.
Состав продуктов хлорирования алканов при низкой температуре подчиняется, таким образом, кинетическому контролю: с большей скоростью реагируют те С–Н-связи, при разрыве которых в качестве промежуточных соединений образуются более устойчивые свободные радикалы.
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
При обсуждении данных о хлорировании гомологов метана следует учитывать следующее важное обстоятельство. В ходе реакции разрываются только С—Н- связи, несмотря на то, что энергии С—С-связей в алканах заметно ниже: например, в этане энергия С—Н-связи составляет 410 кДж/моль (98 ккал/моль), а С—С-связи — 368 кДж/моль (88 ккал/моль). При этом, однако, надо иметь в виду, что за разрывом С—С-связи следует образование С—Сl-связи, имеющей энергию 338 кДж/моль (81 ккал/моль)
CH3 |
|
CH3 + Cl |
|
CH3 |
|
Cl + CH3, |
|
|
|
а за разрывом С—Н-связи следует образование H—Сl-связи, имеющей энергию 431 кДж/моль (103 ккал/моль)
CH3 |
|
CH3 + Cl |
|
CH3 |
|
CH2 + H |
|
Cl. |
|
|
|||||||
|
|
|
|
Полагают, что предпочтительность разрыва С—Н-связей в радикальных реакциях алканов объясняется также и пространственными причинами: С—Н-связи в алканах более доступны для атаки атомарным хлором.
В целом, реакции радикального галогенирования не зависят от полярных эффектов. Однако имеются примеры, когда сильные электроноакцепторные группы (CN, COOH, COOR) затрудняют радикальное хлорирование соседнего атома углерода. Например, в продуктах хлорирования бутиронитрила отсутствует α-хлорбутиронитрил, а уксусная кислота и вовсе не подвергается радикальному хлорированию.
|
|
Cl |
||
CH3CH2CH2CN + Cl2 |
|
CH3 |
|
CHCH2CN + ClCH2CH2CH2CN |
|
|
|||
|
||||
бутиронитрил |
|
β-хлорбутиронитрил γ-хлорбутиронитрил |
||
Такой результат объясняется тем, что атомы галогенов относятся к так называемым электрофильным радикалам. Алкильные радикалы (нуклеофильные радикалы), напротив, склонны отрывать атомы водорода от углеродных атомов, связанных с электроноакцепторными группами.
Факторы, определяющие относительную устойчивость алкильных радикалов, имеют значение для оценки реакционной способности алканов и в других радикальных реакциях. Несомненную помощь в таких оценках ока-
142 |
|
|
|
|
|
Глава 2. Алканы |
Таблица 2.4. Энергии диссоциации связей* в некоторых соединениях |
||||||
|
|
|
|
|
||
Связь |
Энергия диссоциации, |
|
Связь |
Энергия диссоциации, |
||
|
кДж/моль (ккал/моль) |
|
кДж/моль (ккал/моль) |
|||
|
|
|
|
|
|
|
|
|
Двухатомные молекулы |
|
|
||
H–H |
435 |
(104) |
|
|
|
|
|
|
|
|
|||
F–F |
159 |
(38) |
|
H–F |
568 |
(136) |
Cl–Cl |
242 |
(58) |
|
H–Cl |
431 |
(103) |
Br–Br |
192 |
(46) |
|
H–Br |
366 |
(87,5) |
I–I |
150 |
(36) |
|
H–I |
297 |
(71) |
|
|
|
Алканы |
|
|
|
CH3–H |
435 |
(104) |
|
CH3–CH3 |
368 |
(88) |
|
||||||
CH3CH2–H |
410 |
(98) |
|
CH3CH2–CH3 |
355 |
(85) |
CH3CH2CH2–H |
410 |
(98) |
|
|
|
|
(CH3)2CH–H |
397 |
(95) |
|
|
|
|
(CH3)2CHCH2–H |
410 |
(98) |
|
(CH3)2CH–CH3 |
351 |
(84) |
(CH3)3C–H |
380 |
(91) |
|
(CH3)3C–CH3 |
334 |
(80) |
|
||||||
|
|
Галогеналканы |
|
|
||
CH3–F |
451 |
(108) |
|
(CH3)2CH–F |
439 |
(105) |
|
||||||
CH3–Cl |
349 |
(83,5) |
|
(CH3)2CH–Cl |
339 |
(81) |
CH3–Br |
293 |
(70) |
|
(CH3)2CH–Br |
284 |
(68) |
CH3–I |
234 |
(56) |
|
(CH3)3C–Cl |
330 |
(79) |
CH3CH2–Cl |
338 |
(81) |
|
(CH3)3C–Br |
263 |
(63) |
CH3CH2CH2–Cl |
343 |
(82) |
|
|
|
|
|
|
|
|
|||
|
|
Вода и спирты |
|
|
||
HO–H |
497 |
(119) |
|
CH3CH2–OH |
380 |
(91) |
|
||||||
CH3O–H |
426 |
(102) |
|
(CH3)2CH–OH |
385 |
(92) |
CH3–OH |
380 |
(91) |
|
(CH3)3C–OH |
380 |
(91) |
* В структурных формулах указаны соответствующие связи.
зывают данные об энергиях гомолитической диссоциации различных связей (табл. 2.4). По данным этой таблицы можно количественно сравнить, в частности, устойчивость ряда алкильных радикалов. Гомолиз СН3–Н- связи в метане, например, требует 435 кДж/моль (104 ккал/моль), что заметно больше, чем необходимо для гомолиза СН3СН2–H-связи в этане — 410 кДж/моль (98 ккал/моль). Различие в этих значениях однозначно определяется большей стабильностью этильного радикала. Более того, дальнейшее накопление метильных групп у радикального центра еще больше стабилизирует соответствующий радикал: энергия гомолитической диссоциации (СН3)3С–Н-связи в изобутане составляет лишь 380 кДж/моль (91 ккал/моль). трет-Бутил-радикал, следовательно, на 13 ккал/моль стабильнее метильного радикала.
2.4. Радикальные реакции |
143 |
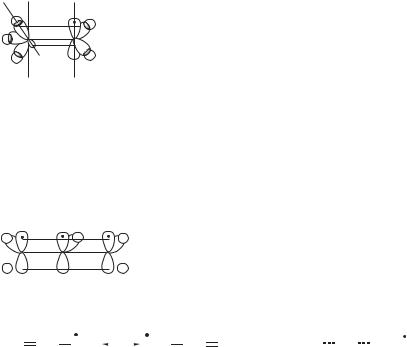
Здесь уместно обсудить механизм стабилизации свободных углеводородных радикалов. Полагают, что преобладающий вклад в устойчивость алкильного радикала вносит эффект сверхсопряжения (гиперконъюгации), показанный на примере этильного радикала:
|
2pz |
|
H |
|
H |
H |
C C |
|
HH
Вследствие того, что 2рz-орбиталь неспаренного электрона и σ-орбитали С–Н-связей не являются параллельными, эффективность их перекрывания относительно невысока. Заместители, содержащие π-орбитали, способны к эффективному сопряжению с соседним радикальным центром и значительно больше повышают устойчивость свободного радикала по сравнению с алкильными группами. Так объясняется, в частности, высокая устойчивость аллильного и (аналогично бензильного) радикала.
2pz 2pz 2pz
HH
 C C C
C C C 
H H
В терминах теории резонанса это выражается следующими резонансными структурами:
[CH |
CH CH |
|
CH |
CH CH ] |
|
[CH |
|
CH |
|
CH ] |
|
|
|||||||||
|
|
|
|
|||||||
2 |
2 |
2 |
2 |
2 |
2 |
|||||
аллильный радикал
Задача 2.4. Напишите структуры всех возможных продуктов монохлорирования указанных ниже соединений и предскажите относительные количества, в которых они
получаются: |
|
|
а) бутан; |
б) 2,3-диметилбутан; |
в) 2,2,3-триметилбутан |
2.4.3.Реакции алканов с другими галогенами
Алканы реагируют и с другими галогенами, причем также по радикальноцепному механизму. При этом состав продуктов в реакциях галогенирования алканов определяется не только относительной устойчивостью промежуточно образующихся алкильных радикалов, т. е. строением субстрата, но и активностью атома галогена, атакующего молекулу алкана. Для сравне-

144 Глава 2. Алканы
ния ниже приведены тепловые эффекты отдельных стадий и суммарные теплоты реакций хлорирования и бромирования метана.
|
|
|
|
|
|
|
|
|
|
|
H°, кДж/моль (ккал/моль) |
|
|
|
|
|
|
|
|
|
|
|
|
X = Cl |
X = Br |
Стадия 1: |
Х2 |
|
|
|
2Х |
|
|
|
242,7 (58) |
(46) |
||
|
|
|
|
|
||||||||
Стадия 2: |
СН4 |
+ Х2 |
|
|
|
|
СН3 + НХ |
8,4 (2) |
(16) |
|||
|
|
|
||||||||||
Стадия 3: |
СН3 |
+ Х2 |
|
|
|
СН3Х + Х |
–111,7 (–26,7) |
(–21) |
||||
|
|
|
||||||||||
Стадия 4: |
Х + Х |
|
Х2 |
–242,7 (–58) |
(–46) |
|||||||
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H° = –103,3 (–24,7) |
(–5) |
Как показывают теплоты отдельных стадий, атомы брома образуются легче, чем атомы хлора, но оказываются менее активными при взаимодействии с молекулами алкана: энергетический барьер взаимодействия атомарного брома с алканом на 14 ккал/моль выше аналогичного барьера в реакции хлорирования. Вследствие этого скорость бромирования алканов значительно ниже скорости хлорирования. Меньшая активность бромирующего агента ведет к значительному росту региоселективности бромирования:
Br
CH3CH2CH3 + Br2 |
300 °C, hν |
|
|
+ CH3CH2CH2Br |
|
CH3CHCH3 |
|||||
|
|||||
пропан |
|
2-бромпропан (92%) 1-бромпропан (8%) |
|||
В соответствии с этими результатами при бромировании пропана величины относительной активности вторичных и первичных С–Н-связей равны 34,5 : 1.
Имеются данные и о большем различии в относительных скоростях бромирования разных С–Н-связей.
Соединение |
R3CH |
R2CH2 |
RCH3 |
С–Н-связь |
третичная |
вторичная |
первичная |
Относительная активность |
|
|
|
C–H-связи |
1640 |
82 |
1 |
Более высокая региоселективность указывает, что эти данные получены для бромирующего агента, обладающего меньшей активностью, в частности, при 100–150 °С.
Задача 2.5. Укажите качественный состав изомеров, образующихся при монобромировании 2,2-диметилбутана, а также строение преобладающего изомера.

2.4. Радикальные реакции |
145 |
С формальной точки зрения можно обсуждать возможность галогенирования каждым из галогенов. Вместе с тем алкилиодиды не получают иодированием алканов. Причина этого факта заключается в низкой активности атомов иода и значительной эндотермичности реакции.
Ниже приводятся значения теплот галогенирования метана.
Галоген |
F2 |
Cl2 |
Br2 |
I2 |
H °, кДж/моль |
435,1 |
103,3 |
25,1 |
58,8 |
(ккал/моль) |
(–104) |
(–24,7) |
(–6) |
(+14) |
Согласно определению
G° = Н° — T S°,
эндотермические реакции (какой является иодирование) имеют Kравн > 1 только в том случае, если член T S° превышает по абсолютной величине Н°:
G° = –2,3 RT lgKравн.
Однако иодирование алканов имеет S° ≈ 0. В итоге эта реакция не идет в обычных условиях. Молекулярный иод очень легко диссоциирует на атомы, которые, однако, оказываются нереакционноспособными.
Напротив, фторирование является высокоэкзотермическим процессом: бóльшая часть органических соединений реагирует со фтором со взрывом. Молекулярный фтор, таким образом, трудно диссоциирует на атомы, но атомы фтора исключительно высокореакционноспособны.
Алканы можно галогенировать также смешанными галогенами, например ICl,
R–H + ICl  R–Cl + HI
R–Cl + HI
и хлористым сульфурилом, например в присутствии дибензоилпероксида:
R H + SO2Cl2 |
(C6H5COO)2 |
R Cl |
+ HCl + SO2 |
|
2.4.4.Другие радикальные реакции
Нитрование алканов
Нитрование алканов впервые провел М.И. Коновалов действием 10–20%-й азотной кислоты при 120–150 °С (реакция Коновалова, 1888 г.). В настоящее время известно несколько схем промышленного нитрования алканов: в жидкой фазе при 100–150 °С и в газовой фазе при 350–500 °С. Концентрация азотной кислоты изменяется в пределах 40–70%.
R–H + HNO3  R–NO2 + H2O
R–NO2 + H2O

146 |
Глава 2. Алканы |
Реакция идет по свободнорадикальному механизму:
HNO2 + HNO3  H2O + 2
H2O + 2 NO2,
NO2,
R |
|
H + NO2 |
|
R + HNO2, R + NO2 |
|
R |
|
NO2 |
|
|
|
|
В более концентрированной азотной кислоте (60–70%-й) источником радикала •NO2 может быть и разложение молекулы HNO3.
HNO3  •NO2 + •OH,
•NO2 + •OH,
2HNO3  •NO3 + •NO2 + H2O.
•NO3 + •NO2 + H2O.
Алканы нитруют также в жидкой или газовой фазе с применением тетраоксида азота N2O4.
Мононитро-н-додекан. В нагретый до 180–190 °С н-додекан через трубку с пористой стеклянной пластинкой пропускают в течение 3 ч перегретую 65%-ю азотную кислоту. Выход мононитрододекана (в виде смеси изомеров) составляет 40% от теоретического. Из реакционной массы выделяют также 43% исходного додекана.
В отличие от галогенирования свободнорадикальное нитрование не протекает по цепному механизму: в стадии образования нитросоединения не возобновляется какой-либо из промежуточных свободных радикалов. Вместе с тем, как и в случае других свободнорадикальных реакций алканов, состав продуктов их нитрования также определяется способностью различных С–Н-связей к гомолитическому разрыву. Однако в отличие от реакций галогенирования в ходе реакций нитрования часто наблюдается разрыв и С–С-связей (деструктивное нитрование).
Сульфохлорирование
Сульфохлорирование алканов при УФ-облучении, при комнатной температуре, протекает как цепной радикальный процесс (реакция Рида, 1936 г.). В качестве продуктов при этом получают хлорангидриды алкансульфокислот:
R |
|
H + SO2 + Cl2 |
hν |
RSO2Cl + HCl |
|
|
Ниже показана последовательность элементарных стадий:
Cl2 |
|
|
hν |
2 Cl , |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
H + Cl |
|
|
|
|
R |
+ |
HCl, |
|||||||
|
|
|
|
||||||||||||||
R |
+ SO2 |
|
|
|
|
|
R |
|
|
|
SO2, |
||||||
|
|
|
|
|
|
|
|||||||||||
R |
|
|
SO2 + Cl2 |
|
|
|
|
|
R |
|
SO2Cl + Cl . |
||||||
|
|
|
|
|
|
|
|
||||||||||

2.4. Радикальные реакции |
147 |
Присутствие атомарного хлора в реакционной смеси неизбежно должно вести к конкуренции сульфохлорирования и хлорирования. Чтобы подавить хлорирование, реакцию проводят в присутствии большого избытка SO2. Еще одной особенностью реакции сульфохлорирования является тот факт, что при наличии в молекуле углеводорода первичных, вторичных и третичных атомов углерода замещению не подвергаются атомы водорода при третичном углеродном атоме:
CH3 |
|
CHCH2CH3 + SO2 + Cl2 |
hν |
|
CH3 |
|
CH |
|
|
|
CH |
|
CH3 |
+ HCl |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|||||||||||
|
|
CH3 |
|
|
|
|
CH3 |
|
SO2Cl |
|
||||
2-метилбутан |
|
3-метил-2-хлорсульфонилбутан |
||||||||||||
Предполагают, что причиной такой особенности реакции является пространственная затрудненность подхода объемистого реагента к третичному атому углерода.
Сульфоокисление
Сульфоокисление алканов при УФ-облучении
R |
|
H + SO2 + O2 |
hν |
R |
|
SO3H |
+ H2O |
|
|
|
|||||
|
|
также протекает как радикально-цепной процесс.
Следует отметить особое значение реакций сульфохлорирования и сульфоокисления для производства алкансульфокислот, имеющих различное применение, в том числе в качестве моющих средств (детергентов). «Моющие» свойства алкансульфокислот основаны на поверхностной активности молекул этих соединений. Имея два фрагмента в своем соcтаве — гидрофобный (фрагмент алкана) и гидрофильный (сульфогруппа), молекулы алкансульфокислот приобретают способность ориентироваться на границе раздела фаз, обеспечивая тем самым перенос загрязнений в водную фазу и их удаление с загрязненного материала (см. т. III, разд. 21.7). Но не стоит забывать, что производство и применение алкансульфокислот как детергентов создает значительные экологические проблемы: бактерии окружающей среды хорошо разлагают соли алкансульфокислот с неразветвленной углеродной цепью, но они не могут «питаться» алканами с разветвленной цепью.
Окисление алканов
Окисление алканов также имеет радикальный механизм и может быть полным (с образованием диоксида углерода и воды)
CH4 + 2O2  CO2 + 2H2O
CO2 + 2H2O
или частичным (с образованием СО или элементного углерода)
2CH4 + 3O2  2CO + 4H2О, CH4 + O2
2CO + 4H2О, CH4 + O2  C + 2H2O.
C + 2H2O.

148 |
Глава 2. Алканы |
Как следует из данных разд. 2.2, смеси, образующиеся при частичном окислении метана, следует считать наиболее перспективным сырьем для получения синтетических алканов в промышленных масштабах.
Примером полного окисления алканов является использование их в качестве топлива на тепловых электростанциях и применение бензиновых фракций в двигателях внутреннего сгорания. В последнем случае используют разветвленные алканы, поскольку линейные алканы в двигателях взрываются (детонируют).
Свойства бензинов характеризуют октановым числом (о.ч.). При этом принимают, что 2,2,4-триметилпентан (изооктан) — один из изомеров октана — имеет октановое число, равное 100, а н-гептан — октановое число, равное нулю.
СН3 СН3
||
СН3–С–СН2–СН–СН3
|
СН3 2,2,4-триметилпентан
Октановое число любого бензина равно содержанию (в об. %) триметилпентана в смеси триметилпентан–н-гептан, которая обладает одинаковыми детонационными свойствами с испытуемым бензином.
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Поскольку окисление алканов имеет радикальный механизм, их относительная активность в окислительных реакциях изменяется в том же ряду, что и при галогенировании. Легче всего окисляются сильноразветвленные алканы, поскольку из них образуются устойчивые третичные радикалы. Труднее всего окисляются алканы линейного строения, что и находит отражение в значениях октановых чисел.
Топливо для двигателей внутреннего сгорания производят ректификацией нефти. При этом получают следующие основные фракции:
Т. кип., °С |
Фракция |
Состав |
|
< 25 |
Газ |
С1 |
— С4 |
25–95 |
Легкий бензин |
С5 — С11 |
|
95–150 |
Нафта |
С12 |
|
150–230 |
Керосин |
С12 |
— С15 |
230–340 |
Газойль |
С15 |
— С25 |
– |
Нелетучий остаток |
> С25 |
|
2.4. Радикальные реакции |
149 |
В качестве топлива для автомобилей используют средние фракции, а нелетучий остаток перерабатывают в смазочные масла, смазки, парафин, асфальт.
Окисление метана наблюдается и при действии воды в присутствии катализатора при высокой температуре:
Ni, 850 °C
CH4 + H2O  CO + 3H2
CO + 3H2
Процесс сопровождается получением синтез-газа — сырья для синтеза алканов по Фишеру–Тропшу (см. выше, разд. 2.2.2) — и значительного числа важнейших органических соединений.
Термолиз
Термолиз алканов также имеет радикальную природу, но протекает с образованием различных продуктов в зависимости от условий.
2CH4 |
1200 °C, 0,01 c |
HC≡CH + 3H2 |
|||||
|
800 °C |
||||||
CH3CH3 |
CH2=CH2 + H2 |
||||||
|
|
|
|||||
CH3CH2CH2CH3 |
|
Cr2O3/Al2O3 |
|
||||
|
450 °C |
||||||
 CH2=CH–CH2–CH3 + CH3–CH=CH–CH3 + H2
CH2=CH–CH2–CH3 + CH3–CH=CH–CH3 + H2
К термическим реакциям алканов относят также крекинг и риформинг. Так называют химические процессы, применяемые в промышленности для переработки нефтяного сырья. Их целью является повышение выхода и качества бензиновых фракций, пригодных для использования в качестве моторного топлива.
Крекингу подвергают высококипящие нефтяные остатки, получаемые при перегонке нефти. В ходе крекинга более высокомолекулярные алканы превращаются в низкомолекулярные. Это достигается, в частности, применением очень высокой температуры — до 700–900 °С (термический крекинг).
Недостатком термического крекинга является то, что его продукты не содержат значительных количеств разветвленных алканов, вследствие чего с его помощью не удается получать моторное топливо с октановым числом выше 65–70. Лучших результатов добиваются в схемах каталитического крекинга. Его проводят с применением алюмосиликатного катализатора (типа цеолит Y) и при более умеренных температурах (400–450 °С).
Еще более эффективным процессом получения моторного топлива с максимальным значением октанового числа является риформинг. Этот
150 |
Глава 2. Алканы |
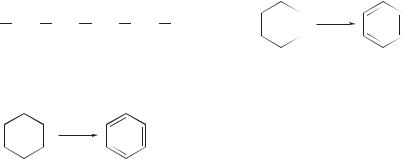
процесс предназначен для превращения средних линейных алканов в циклоалканы и далее в ароматические углеводороды:
CH3 CH2 CH2 CH2 CH2 CH3 
гексан |
|
|
о.ч. = 25 |
циклогексан |
бензол |
|
о.ч. = 83 |
о.ч. = 106 |
CH3 CH3
метилциклогексан |
толуол |
о.ч. = 70 |
о.ч. = 120 |
В отличие от каталитического крекинга, который проводят на катализаторах кислотного типа, в процессах риформинга используют дегидрирующие гетерогенные катализаторы. Если в процессе риформинга применяют платинорениевые катализаторы, такой процесс называют
платформингом.
Термокаталитические методы переработки нефтяных фракций лежат в основе производства углеводородного сырья для промышленности основного органического синтеза.
2.5.ТЕПЛОТЫ ОБРАЗОВАНИЯ МОЛЕКУЛ И ТЕПЛОТЫ РЕАКЦИЙ
2.5.1.Теплоты сгорания, теплоты образования и стабильность органических молекул
Выше мы познакомились со значениями теплот некоторых реакций алканов, в частности галогенирования и окисления. Ценность таких данных состоит не только в том, что они характеризуют изменение энтальпии в ходе соответствующих превращений алканов, но и являются основой для получения оценок теплот образования и стабильности других органичес-
ких молекул.
Теплота образования ( Н°f ) характеризует изменение энтальпии при образовании соединения непосредственно из элементов. Лишь в отдельных случаях теплота образования может быть определена прямо: например, теплоты образования СО2 и Н2О могут быть найдены непосредственно как теплоты сгорания углерода и водорода.
