
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf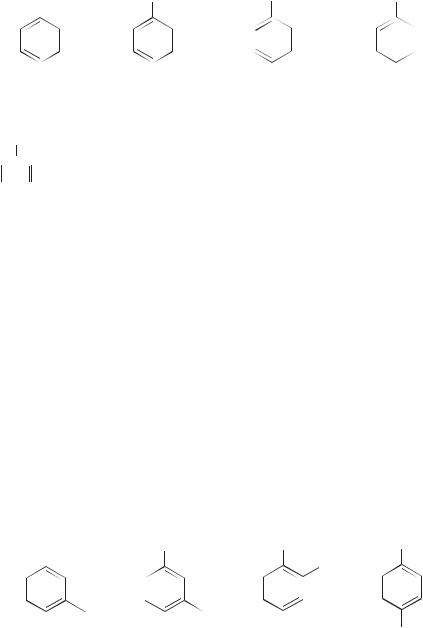
9.6. Электрофильное замещение в полизамещенных бензолах |
81 |
|||||||
Br |
I |
NO2 |
COOC2H5 |
|||||
0,03 |
0,2 |
|
1,8 · 10–6 |
|
|
1 · 10–4 |
||
|
0,0011 |
|
0,01 |
|
28 · 10–6 |
|
|
2,5 · 10–4 |
|
|
|
|
|||||
0,11 |
|
0,6 |
|
0,2 · 10–6 |
0,24 · 10–4 |
|||
Задача 9.5. Факторы парциальных скоростей нитрования трет-бутилбензола показаны на диаграмме:
C(CH3)3
 5,5
5,5
 4 75
4 75
Какова относительная скорость нитрования трет-бутилбензола по сравнению с бензолом?
9.6.ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ В ПОЛИЗАМЕЩЕННЫХ БЕНЗОЛАХ. СОГЛАСОВАННАЯ
И НЕСОГЛАСОВАННАЯ ОРИЕНТАЦИЯ
При определении ориентации в реакциях электрофильного замещения в ди- и полизамещенных бензолах необходимо учитывать электронное влияние всех уже присутствующих в исходном соединении заместителей. При этом принципиально возможны два варианта суммарного влияния этих заместителей: согласованная и несогласованная ориентация атаки электро-
фильного агента.
Cогласованная ориентация — ориентация в дизамещенных (или полизамещенных) бензолах, при которой оба (все) заместителя направляют атаку электрофила в реакциях SEAr в одно и то же (или в одни и те же) положение бензольного кольца. Ниже в формулах эти положения отмечены звездочкой.
|
I |
|
|
|
II |
I |
|
I |
* |
|
* |
|
|
* |
II |
* |
* |
|
* |
|
|
|||||
|
|
I |
|
II |
|
|
|
|
|
|
|
|
|
|
|||
* |
|
|
* |
|
II |
|||
|
|
|
|
|
|
|
|
|
(I — заместитель первого рода, II — заместитель второго рода)
Далее приведены примеры соединений, в которых имеет место согласованная ориентация заместителей.
82 |
Глава 9. Электрофильное замещение в ароматическом ряду |
В молекуле 4-нитротолуола
32
O2N 4
 1 CH3
1 CH3
56
метильная группа как орто,пара-ориентант направляет электрофильную атаку в реакциях SEAr в положения 2 и 6; нитрогруппа как мета-ориентант направляет электрофильную атаку в те же положения 2 и 6.
O2N |
|
CH3 |
HNO3 |
O2N |
|
CH3 + H2O |
|
H2SO4 |
|
||||
4-нитротолуол |
|
|
NO2 |
|||
|
|
|
|
2,4-динитротолуол |
||
В молекуле 3-трифторметилбензойной кислоты
56
1
4
 3 2
3 2
O
C
OH
F3C
и карбоксильная, и трифторметильная группы как мета-ориентанты направляют электрофильную атаку в положение 5.
|
|
|
|
|
Br |
|
||
|
|
O |
+ Br2 |
Fe, t |
|
|
O |
+ HBr |
|
|
|
||||||
|
|
C |
|
|
C |
|||
|
|
|
|
|
||||
|
|
OH |
|
|
|
|
OH |
|
F3C |
|
|
F3C |
|
||||
3-трифторметил- |
|
|
3-бром-5-трифторметил- |
|
||||
бензойная кислота |
|
|
бензойная кислота |
|
||||
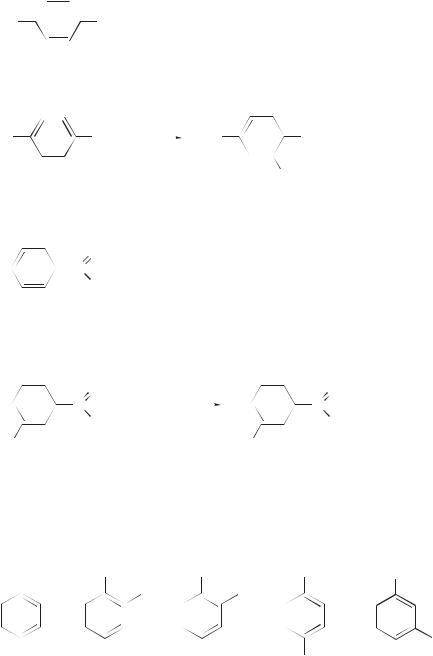
Несогласованная ориентация — ориентация в дизамещенных (или полизамещенных) бензолах, при которой оба (все) заместителя направляют атаку электрофильного агента в реакциях SEAr в различные положения бензольного кольца.
|
I |
|
|
|
I |
|
II |
|
|
II |
|
|
I |
|
* |
|
* |
|
|
|
I |
|
II |
* |
|
|
|
||
|
** |
|
|
** |
|
|
* |
|
* |
|
* |
|||
|
|
|
|
|
|
|
||||||||
** |
|
** |
* |
|
* |
* |
|
* |
* * |
|
* * |
** |
|
II |
|
|
|
|
|
||||||||||
|
|
|
|
** |
** |
|
|
|
|
|
* |
|||
|
|
|
|
|
|
|
|
|
|
|||||
I |
II |
9.6. Электрофильное замещение в полизамещенных бензолах |
83 |
Несогласованная ориентация заместителей заметно затрудняет проведение реакций электрофильного ароматического замещения в препаративных целях. Ситуация, однако, не является столь безнадежной, какой она может показаться на первый взгляд. Дело в том, что состав продуктов реакции при несогласованной ориентации заместителей подчиняется определенным правилам:
1) все орто,пара-ориентанты доминируют над мета-ориентантами:
CH3 |
|
|
CH3 |
|
|
CH3 |
CH3 |
||||||||||
|
|
Cl2 , Fe, t |
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
+ |
|
|
|
|
|
+ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
–HCl |
|
|
|
|
|
|
|
|
|
|
|
|||
|
NO2 |
|
|
|
|
|
NO2 |
|
|
|
NO2 |
|
|
NO2 |
|||
3-нитротолуол |
|
|
Cl |
5-нитро-2-хлор- |
3-нитро-4-хлор- |
||||||||||||
|
|
|
3-нитро-4-хлор- |
|
толуол |
толуол |
|||||||||||
|
|
|
|
|
|
толуол |
|
|
|
|
|
(примесь) |
|||||
|
|
|
|
|
|
|
|
|
основные продукты |
|
|
|
|||||
Cl |
|
|
Cl |
|
|
|
Cl |
|
|
|
|||||||
|
|
|
HNO3 |
|
|
|
|
|
|
|
O2N |
|
|
|
|||
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
+ |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
COOH |
|
|
|
|
|
COOH |
||||
3-хлорбензойная |
|
|
NO2 |
|
|
4-нитро-3-хлор- |
|||||||||||
кислота |
|
|
2-нитро-5-хлор- |
|
|
бензойная кислота |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
бензойная кислота |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
основные продукты |
|
|
|
|||||
|
|
|
|
|
|
Cl |
|
|
|
Cl |
|
|
|
||||
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
+ H2O |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
COOH |
|
O2N |
COOH |
|||||
|
|
|
|
|
|
2-нитро-3-хлор- |
|
|
5-нитро-3-хлор- |
||||||||
|
|
|
|
|
|
бензойная кислота |
|
|
бензойная кислота |
||||||||
примеси
84 Глава 9. Электрофильное замещение в ароматическом ряду
2) все активирующие орто,пара-ориентанты доминируют над галогенами (дезактивирующие орто,пара-ориентанты):
NHCH3 NHCH3
Br
Br2
CH3COOH
+ HBr
Cl |
|
|
Cl |
|
|
||
4-хлор- |
|
|
2-бром-4-хлор- |
|
|
||
N-метиланилин |
|
N-метиланилин (87%) |
|
|
|||
Cl |
|
|
Cl |
Cl |
|||
|
|
HNO3 |
|
|
|
|
NO2 |
|
|
|
|
+ |
|
+ H2O |
|
|
|
|
|
|
|||
|
|
H2SO4 |
|
|
|
||
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
CH3 |
|||
4-хлортолуол |
|
2-нитро-4-хлортолуол |
3-нитро-4-хлортолуол |
||||
|
|
|
|
(основной продукт) |
(примесь) |
||
3) сильно и умеренно активирующие орто,пара-ориентанты (–NH2, –OH, –OCH3 и т.п.) доминируют над более слабыми орто,пара-ориентан- тами (CH3, СН2СН3 и т. п.):
CH3 |
|
CH3 |
|
CH3 |
||||
|
|
Br2 |
|
|
|
|
|
Br |
|
|
|
|
+ |
|
+ HBr |
||
|
|
|
|
|||||
|
|
CH3COOH |
|
Br |
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
NH2 |
|
NH2 |
|
NH2 |
||||
п-толуидин |
|
4-амино-3-бромтолуол |
|
4-амино-2-бромтолуол |
||||
|
|
|
(основной продукт) |
|
(примесь) |
|||
При обсуждении влияния нескольких заместителей на региоселективность электрофильного замещения следует учитывать также и пространственный фактор. Например, нитрование 4-трет-бутилтолуола идет почти исключительно в орто-положение к метильной группе:
CH3 |
|
CH3 |
|||
|
|
HNO3 |
|
NO2 |
|
|
|
|
+ H2O |
||
|
|
||||
|
|
H SO |
|
||
|
2 |
4 |
|
|
|
C(CH3)3 |
|
C(CH3)3 |
|||
4-трет- |
4-трет-бутил- |
бутилтолуол |
2-нитротолуол (88%) |
9.6. Электрофильное замещение в полизамещенных бензолах |
85 |
Данные о сравнительной ориентирующей способности заместителей, находящихся в бензольном ядре, позволяют выбирать оптимальный путь синтеза того или иного замещенного бензола. Например, при выборе способа получения м-хлорэтилбензола следует исключить хлорирование или алкилирование, соответственно, этилбензола или хлорбензола, поскольку и хлор, и этильная группа — орто,пара-ориентанты.
Оптимальной является схема, предполагающая первоначальное ацетилирование бензола, хлорирование полученного ацетофенона, а на завершающей стадии — восстановление карбонила ацетильной группы:
|
|
|
O CH3 |
|
O CH3 |
|
|
|
|
|||
|
|
|
C |
|
C |
|
CH2CH3 |
|||||
|
|
CH3COCl |
|
Cl2 |
|
|
Zn/Hg |
|
|
|||
|
|
|
|
|
|
|||||||
|
|
AlCl3 |
|
|
AlCl3 |
|
|
Cl |
HCl |
|
|
Cl |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
бензол |
|
ацетофенон |
|
3-хлорацетофенон |
|
3-хлорэтилбензол |
||||||
Синтез п-нитробензойной кислоты — еще один пример такого рода. Поскольку нитро- и карбоксигруппы являются мета-ориентантами, прямое нитрование, например бензойной кислоты, не приведет к искомому изомеру. Целесообразно применить толуол в качестве исходного производного бензола. Толуол нитруют в пара-положение, полученный п-нитротолуол отделяют от орто-изомера, а затем окисляют метильную группу:
CH3 |
CH3 |
COOH |
|||||||
|
|
HNO3 |
|
|
Na2Cr2O7 |
|
|
||
|
|
|
|
||||||
|
|
H2SO4 |
|
|
|
H2SO4 |
|
|
|
|
|
|
|
||||||
|
|
|
NO2 |
NO2 |
|||||
толуол |
п-нитротолуол |
п-нитробензойная |
|||||||
|
|
|
|
|
|
|
|
кислота (82–86%) |
|
Задача 9.6. Покажите, какой продукт преимущественно образуется в следующих реакциях:
|
C(CH3)3 |
|
CF3 |
|
||||
|
|
|
HNO |
|
|
NH2 |
Br2 |
|
а) |
|
3 |
|
б) |
|
|
|
|
|
|
|
|
|
|
CH3COOH |
||
|
|
CH COOH |
|
|
||||
|
3 |
|
|
|
|
|
||
CH(CH3)2 |
O2N |
86 |
Для углубленного изучения |
Для углубленного изучения!
РЕАКЦИИ АРЕНОВ С ДРУГИМИ ЭЛЕКТРОФИЛАМИ
Выше были подробно рассмотрены наиболее важные реакции электрофильного ароматического замещения. Необходимо кратко остановиться и на ряде реакций ароматических субстратов с другими электрофилами. Эти реакции не являются столь же универсальными, как и выше рассмотренные, но имеют значение для синтетической практики.
Большая часть из обсуждаемых в этом разделе электрофильных агентов относится к числу так называемых слабых электрофилов. Такие электрофилы способны реагировать лишь с ароматическими углеводородами, содержащими активирующие заместители (амино- и гидроксигруппы, алкиль-
ные группы).
Формилирование ArH действием оксида углерода и HCl в присутствии кислоты Льюиса (реакция Гаттермана–Коха, 1897 г.). Катализатор в этой
реакции активируют добавками Cu2Cl2 или NiCl2:
AlCl3
ArH + CO + HCl Cu2Cl2 , 40°C ArCHO.
ArCHO.
Электрофильным агентом в реакции выступает комплекс HCOAlCl4. Реакцию проводят с бензолом, хлорбензолом, алкилбензолами, конденсированными бензоидными углеводородами.
Гаттерман предложил еще один метод введения формильной группы в арены с применением смеси безводного НCN и газообразного HCl. Чтобы избежать работы с ядовитой синильной кислотой, Адамс предложил заменить ее цианидом цинка. Формилирование аренов действием цианида цинка и HCl (часто в присутствии хлористого алюминия) с последующим
гидролизом промежуточного продукта получило название реакции Гаттер- мана–Адамса (1898 г.) [1]:
|
|
|
H |
NH2Cl |
|
|
|
СHO |
|
|
|
|
|
|
|
|
|
|
|
СH |
СH |
Zn(CN)2, |
СH |
СH |
HCl, СH |
|
СH |
||
3 |
3 |
3 |
3 |
|
3 |
3 |
|||
|
|
AlCl3, HCl |
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|||
|
СH3 |
C2H4Cl2 |
|
СH3 |
|
|
|
СH3 |
|
|
|
|
|
|
|
||||
мезитилен |
2,4,6-триметил- |
|
бензальдегид |
|
(75–81%) |
Реакции с другими электрофилами |
87 |
Реакцию проводят с фенолами и их эфирами, а также с алкилбензолами. Выходы ароматических альдегидов в этой реакции превышают 80%.
Впоследствии вместо цианидов для введения формильной группы было предложено применять нетоксичный 1,3,5-триазин:
N
|
|
|
|
|
AlCl3, HCl |
|
H3O |
|
|
|
|
|
|
|
|||
ArH + |
|
|
|
|
|
ArCH=NH2Сl |
|
ArCHO + NH4Сl |
|
|
|||||||
N |
N |
|
|
|||||
|
|
|
|
|
55–90% |
|||
|
|
|
|
|
|
|
|
|
Ацилирование ArH нитрилами в присутствии Zn(CN)2 и HCl является развитием реакции Гаттермана–Адамса и включает ее как частный случай [2]:
|
|
|
|
|
|
O |
||
ArH + RCN |
Zn(CN)2, HCl |
ArC(R) |
|
NH |
H2O |
|
|
|
|
ArCR |
|||||||
|
|
|
||||||
|
|
|
||||||
Электрофильный агент в этой реакции образуется при протонировании нитрила:
R C N + H
N + H
 R C
R C N H
N H 
 R C
R C N H
N H
Реакцию применяют для активированных ароматических углеводородов:
|
OH |
|
OH |
O |
|||
|
|
1. Zn(CN)2, HCl |
|
|
|
|
CH |
|
|
|
|
|
|
||
|
+ CH3CN |
|
|
|
3 |
||
|
2. H2O |
|
|
|
|
|
|
|
|
|
|
|
|
||
HO |
OH |
HO |
OH |
||||
флюроглицин |
2,4,6-тригидроксиацетофенон |
||||||
|
|
|
|
(74–87%) |
|||
Еще один способ формилирования активированных аренов известен как
реакция Вильсмейера–Хаака (1927 г.) [3]:
ArH + HCON(CH3)2 |
1. POCl3 |
ArCHO |
2. H2O |
Электрофильным агентом в реакции выступает комплекс N,N-диметил- формамида с оксихлоридом фосфора:
|
|
|
OPOCl2 |
H |
|
C |
Cl |
|
|||
|
|
|
N(CH3)2 |

88 |
Для углубленного изучения |
Формилирование ArH действием амидов других карбоновых кислот и РОСl3 является развитием реакции Вильсмейера–Хаака. Реакцию применяют для ароматических соединений, активированных присутствием диал- киламино-, алкокси- и гидроксигрупп [4].
С6H5CONHС6H5 + С6H5N(CH3)2 |
POCl3 |
|
NС6H5 |
H3O |
||
|
|
|
— |
|
||
|
|
|
||||
бензанилид |
N,N-диметиланилин |
С6H5—C—С6H4N(CH3)2 |
||||
|
|
|
|
|
О |
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
С6H5—C—С6H4N(CH3)2
п-диметиламино- бензофенон (72–77%)
Нитрозирование ArH действием нитрита натрия в присутствии сильной минеральной кислоты:
ArH + HNO2 |
H |
ArNO + H2O |
|
Электрофильный агент в этой реакции образуется при взаимодействии азотистой и минеральной кислот:
HNO2 |
+ HCl |
|
|
NOCl + H2O |
|
|
|
||||
|
|
|
|
хлористый |
|
|
|
|
|
нитрозил |
|
HNO2 |
+ HBr |
|
|
NOBr + H2O |
|
|
|
||||
|
|
|
|
бромистый |
|
|
|
|
|
нитрозил |
|
HNO2 |
+ 2H2SO4 |
|
|
NO + H3O + 2HSO4 |
|
|
|
||||
|
|
|
|
нитрозоний- |
|
|
|
|
|
|
ион |
И хлористый нитрозил, и бромистый нитрозил, и ион нитрозония отно-
сятся к числу слабых электрофилов. Например, ион нитрозония NO, образующийся в смеси нитрита натрия с концентрированной серной кислотой,
в 1014 раз менее активен, чем ион нитрония NO2. Нитрозированию подвергают поэтому лишь активированные ароматические соединения (подробнее об этой реакции см. в разд. 17.4.4 и в т. III, разд. 23.4.4).
Азосочетание ArH с солями арендиазония
Соли арендиазония также относятся к числу слабых электрофилов и могут взаимодействовать только с активированными ароматическими соединениями.
ArH + Ar'N2 X
X
 Ar N
Ar N N Ar' + HX
N Ar' + HX
Особенностью реакции азосочетания является значительный изотопный кинетический эффект (подробнее об этой реакции см. в т. III, гл. 24).

Реакции с другими электрофилами |
89 |
Реакции SEAr производных карбоновых и сульфоновых кислот
O |
|
R C O X и |
R SO2OX |
составляют особую группу электрофильных реагентов. Они отличаются тем, что в ходе реакций с ароматическими субстратами легко отщепляют низкоосновные карбонат- и сульфат-ионы, например СF3COO и CF3SO2O , являющиеся очень хорошими уходящими группами (подробнее см. об этом в разд. 13.4.1). Благодаря этому применение указанных производных, как правило, не требует присутствия катализатора [5]. Некоторые из электрофильных реагентов этой группы уже были названы выше.
ArH + CH3COONO2  ArNO2 + CH3COOH
ArNO2 + CH3COOH
ацетилнитрат
ArH + CF3COOBr  ArBr + CF3COOH
ArBr + CF3COOH
трифтороацетилгипобромит
ArH + CF3SO2OCOCH3  ArCOCH3 + CF3SO2OH
ArCOCH3 + CF3SO2OH
ацетилтрифлат
Особое внимание следует обратить на новые ацилирующие агенты — ацилпроизводные трифторметансульфоновой кислоты (ацилтрифлаты). Эти производные представляют собой смешанные ангидриды карбоновых кислот и трифторметансульфоновой кислоты и обладают высокой активностью [6, 7]. Они способны, например, ацилировать бензол в отсутствие ка- кого-либо катализатора:
С6H6 + CF3SO2OCOCH3 |
|
С6H5COCH3 + CF3SO3H |
|
|
|||
бензол |
ацетилтрифтор- |
|
ацетофенон трифторметан- |
|
метансульфонат |
|
сульфоновая кислота |
По-видимому, по такой же схеме реагирует с ароматическими соединениями и ряд других производных уксусной и трифторуксусной кислот:
|
|
CH3COOH |
|
|
|
С6H5OCH3 |
|
|
СH3О |
|
СОСH3 |
|
|
||||
|
(CF3CO)2O, Al2O3 |
|
|
||
|
|
25 °C, 10 мин |
|
|
|
CH3COOH
(CF3CO)2O, Al2O3
S25 °C, 25 мин
SСОСH3

90 |
Для углубленного изучения |
Гидроксилирование ArH действием трифторпероксиуксусной кислоты представляет собой уникальный пример электрофильного гидроксилирования. Особенно хорошие результаты получены в гидроксилировании полиметилбензолов (мезитилен, изодурол и т. п.) [8]:
ArH + CF3 |
|
C |
O |
BF3 |
ArOH + CF3COOH |
||
|
|
|
|
||||
|
O |
|
OH |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
Со способностью ацетата ртути выступать в качестве электрофильно-
го агента мы уже знакомились в реакции оксимеркурирования алкенов (т. I, разд. 5.4.1). Меркурирование ArH в присутствии трифторуксусной ки-
слоты также протекает по схеме электрофильного ароматического замещения.
CF3COOH
C6H6 + Hg(OCOCH3)2  C6H5HgOCOCH3 + CH3COOH
C6H5HgOCOCH3 + CH3COOH
Первоначально образующийся трифторацетат ртути
Hg(OCOCH3)2 + CF3COOH 
 CF3COOHgOCOCH3 + CH3COOH
CF3COOHgOCOCH3 + CH3COOH
способен легко диссоциировать с отщеплением меркуриниевого иона:
CF3COOHgOCOCH3 
 CF3COO
CF3COO + HgOCOCH3,
+ HgOCOCH3,
C6H6 +  HgOCOCH3 CF3COOH Ar HgOCOCH3 + H
HgOCOCH3 CF3COOH Ar HgOCOCH3 + H
Меркурирование — одна из немногих реакций SEAr, в которых стадия выброса протона из σ-комплекса является скоростьлимитирующей
kH/kD = 6 [9, 10].
Таллирование аренов легко проводится трифторацетатом таллия(III) [11]:
C6H6 + (CF3COO)3Tl |
CF3COOH |
C6H5Tl(OCOCF3)2 |
+ CF3COOH |
|
|||
трифторацетат |
|
арилталлий |
|
таллия |
|
трифторацетат (96%) |
|
Ароматические производные ртути и, особенно, таллия обладают высокой реакционной способностью, что позволяет вводить в молекулы ароматических соединений самые разнообразные функциональные группы (атомы галогенов, группы COOR, CO, NO, CN, OH). При этом, однако, следует иметь в виду весьма высокую токсичность соединений ртути и таллия. Подробнее о химии элементоорганических соединений см. в гл. 15.
