
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
9.2. Наиболее важные реакции |
61 |
при алкилировании бензола н-пропилхлоридом преимущественно образуется кумол (изопропилбензол):
|
|
|
|
|
|
CH3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CH2CH2Cl |
|
CH |
|
CH3 |
+ |
CH2CH2CH3 |
||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
AlCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
изопропилбензол (65%) |
н-пропилбензол (35%) |
||||||
|
|
|
|
|
|
CH3 |
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
бензол |
CH3C(Cl)HCH |
3 |
|
CH |
|
CH3 |
+ HCl |
||||
|
|
||||||||||
|
|
|
|
|
|||||||
|
|
|
AlCl3 |
|
|
|
|
||||
|
|
|
|
|
|
||||||
изопропилбензол
Образование изопропил-катиона из н-пропилхлорида происходит, повидимому, на стадии ионизации ДАК:
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
CH3 |
|
|
|
|
|
|
Cl + AlCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
CH2 |
|
|
|
|
CH3 |
|
C |
|
CH2 |
|
|
Cl |
|
AlCl3 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
CH3 |
AlCl4 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Галогениды, не способные ионизироваться до карбокатионов в указанных условиях, являются неактивными в реакциях Фриделя–Крафтса. Это относится, в частности, к винилхлориду, который не образует винилкатион СН2=СН при обработке хлоридом алюминия.
Кроме изомеризации алкилирующего агента, среди процессов, сопровождающих алкилирование бензола по Фриделю–Крафтсу, следует отметить полиалкилирование:
|
|
|
|
|
|
|
|
CH3 |
|
|
|
||
|
|
|
|
CH3 |
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
CH3Br + |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
+ AlCl3 |
|
о-ксилол |
|
||||
|
|
+ CH3Br + AlCl3 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензол |
|
|
толуол |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|||||||||
CH3
п-ксилол
62 |
Глава 9. Электрофильное замещение в ароматическом ряду |
К числу реакций Фриделя–Крафтса относят и другие процессы алкилирования, в которых также могут образоваться карбокатионы, способные выступать электрофильными агентами.
|
|
|
H2C |
|
CH2 |
|
|
CH2CH3 |
|
||||
|
|
|
|
|
|
этилбензол |
|||||||
|
|
|
|
H2SO4 |
|
CH3 |
|
||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
OH |
|
|
||||||
|
|
|
|
|
|
CH |
|
||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH3 |
|
|
CH3 |
изопропилбензол |
|||
|
|
|
|
|
|
||||||||
|
|
|
|
H3PO4 |
|
||||||||
|
|
|
|
|
C(CH3)3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензол |
(CH3)3COH |
|
|
|
|||||||||
|
|
трет-бутилбензол |
|||||||||||
|
|
||||||||||||
|
|
|
|
H3PO4 |
|
CH2Cl |
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
CH2O |
|
|
|||||||
|
|
|
|
|
|
хлорметилбензол |
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl + ZnCl2 |
|
|
||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
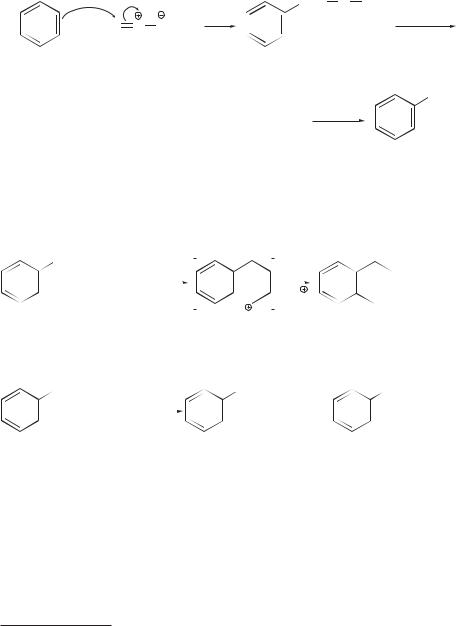
При применении алкенов как алкилирующих агентов в качестве катализатора применяют смеси HCl + AlCl3 и HF + BF3, а также фосфорную кислоту. Алкилирование спиртами проводят в присутствии BF3 или сильных минеральных кислот (Н3РО4, H2SO4, полифосфорная кислота).
Частным случаем алкилирования считают реакцию хлорметилирования. В ходе этой реакции нагреванием бензола с формальдегидом и HCl в при-
сутствии хлорида цинка с хорошим выходом получают бензилхлорид. Такая модификация реакции алкилирования аренов носит название «хлорметилирование по Блану» (1923 г.):
CH2Cl
+ CH2O HCl + ZnCl2
бензол |
бензилхлорид |
Электрофильный агент при этом образуется за счет комплексообразования формальдегида с ZnCl2:
CH2O + ZnCl2 
 CH2
CH2 O ZnCl2
O ZnCl2 
 CH2 O ZnCl2
CH2 O ZnCl2
9.2. Наиболее важные реакции |
63 |
Последующая атака арена дает сначала σ-комплекс, который затем превращается в Zn-соль бензилового спирта и далее — в хлорметильное производное:
CH2 O ZnCl
+ H C |
O ZnCl |
|
HCl |
|
|
||
2 |
2 |
–HCl |
–ZnCl(OH) |
|
|
бензол
CH2Cl
бензилхлорид
Алкилирование по Фриделю–Крафтсу может проходить и внутримолекулярно. В таких реакциях шестичленное кольцо образуется легче, чем пятичленное. Так, 4-фенил-1-бутанол в фосфорной кислоте дает продукт циклизации с выходом 50 %, а 3-фенил-1-пропанол преимущественно дегидратируется в алкенилбензол:
|
(CH2)3CH2OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
H3PO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–H2O |
|
|
|
–H |
|
|
||
|
|
|
|
|
|
|||||
4-фенил-1-бутанол |
|
|
|
1,2,3,4-тетрагидронафталин |
||||||
|
|
|
||||||||
|
(CH2)2CH2OH |
|
|
CH |
|
CHCH |
CH CH |
|
|
|
CH |
|
|
|
|
|
|||||||
|
|
H3PO4 |
3 |
2 |
|
|
2 |
||||
|
|
|
+ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
3-фенил-1-пропанол |
|
1-пропенилбензол |
аллилбензол |
|
|
||||||
Получение 1,2,3,4-тетрагидронафталина (тетралин) с применением реакций Фриделя–Крафтса представляет собой один из способов аннелирова-
ния* в синтезе конденсированных бензоидных углеводородов (подробнее см. в разд. 11.2.1).
Задача 9.2. Когда бензол реагирует с неопентилхлоридом (CH3)3CCH2Cl в присутствии хлористого алюминия, преобладающим продуктом оказывается 2-метил-2-фенилбутан. Объясните этот факт написанием механизма реакции.
* Аннелированием называют образование в молекуле конденсированного цикла (обычно пятиили шестичленного), например, по приведенной выше схеме.
64 |
Глава 9. Электрофильное замещение в ароматическом ряду |
9.2.5.Ацилирование по Фриделю–Крафтсу
O
||
Фрагмент карбоновой кислоты R—C— называют ацилом, или ацильной группой. В качестве примера ацилов можно назвать ацетильную и бензоильную группы — фрагменты уксусной и бензойной кислот соответственно.
|
|
O |
|
|
O |
||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||
ацетильная группа |
бензоильная группа |
||||||||||||
Замещение атома водорода в аренах на ацильную группу при взаимодействии арена с галогенангидридом или ангидридом в присутствии кислоты Льюиса называют ацилированием по Фриделю–Крафтсу. Продукт выделяют, разлагая реакционный комплекс разбавленной HCl при охлаждении.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
AlCl3 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
C |
CH3 |
|
|
|
|
|
|
|
|
|
||||||||
|
+ CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3O |
||||||||
|
|
|
C |
+ AlCl |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
+ HCl |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
3 |
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензол ацетилхлорид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетофенон |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(метилфенилкетон) |
||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
CH3 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
AlCl3 |
|
|
H3O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
+ |
|
|
|
O |
|
|
|
|
|
|
|
|
|
+ CH3COOH |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
CH3 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
бензол |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
ацетофенон |
|
|
|
|
|
|
|
|
|
||||||||||||
|
уксусный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
ангидрид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
+ |
|
|
|
C |
|
|
AlCl3 |
|
|
H3O |
|
|
|
|
|
|
|
|
+ HCl |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Cl
бензол |
бензоилхлорид |
бензофенон |
|
|
(дифенилкетон) |

9.2. Наиболее важные реакции |
65 |
Вкачестве кислоты Льюиса применяют галогениды алюминия, трифторид бора, пентафторид сурьмы. Чаще всего, однако, ацилирование проводят
вприсутствии AlCl3, используя нитробензол, сероуглерод, тетрахлорэтан, 1,2-дихлорэтан или хлористый метилен как растворитель.
Вреакциях с активными аренами в качестве растворителя также можно применять бензол.
Ацетофенон. К охлаждаемой смеси безводного хлорида алюминия (53 г; 0,4 моль) в сухом бензоле (88 г; 1,13 моль) медленно при хорошем размешивании прибавляют ацетилхлорид (29 г; 0,37 моль). По окончании смешения реакционную массу нагревают 1 ч при 50 °С и охлаждают. Реакционный комплекс разрушают водой со льдом. Органический слой отделяют, промывают водой и сушат. Продукт выделяют перегонкой, т. кип. 201 °С. Выход 27 г (61%).
Поскольку продукт реакции — жирно-ароматический или ароматический кетон — находится в конечной реакционной смеси в виде комплекса с AlCl3, в ацилировании по Фриделю–Крафтсу применяют более, чем эквимольное количество катализатора (обычно 1,1 моль катализатора на 1 моль галоген-ангидрида или 2,1 моль катализатора на 1 моль ангидрида).
Стадия 1 — образование электрофильного агента:
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
C + AlCl3 |
|
|
|
|
|
|
|
CH3 |
|
C |
|
|
O |
|
AlCl3 |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
ДАК |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
O |
|
|
CH3 |
|
C |
|
O |
+ AlCl4 |
|||||||
|
|
|
|
C AlCl4 |
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
ионная пара |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетил-катион |
||||||||||||||
Стадия 2 — каждая из образующихся при этом электрофильных частиц (ДАК, ионная пара, ацетил-катион) может реализовать последующую атаку арена. Такая атака протекает по стандартной схеме реакций электрофильного ароматического замещения:
|
H |
O |
|
|
|
+ CH C O |
C |
AlCl4 |
быстро |
||
3 |
медленно |
CH3 |
|
|
 O AlCl3
O AlCl3
C
CH3
+ HCl
66 |
Глава 9. Электрофильное замещение в ароматическом ряду |
Вероятность образования свободного ацилий-катиона как электрофильного агента в реакциях ацилирования по Фриделю–Крафтсу достаточно высока, поскольку такой ион является сравнительно устойчивым резонанс- но-стабилизированным катионом.
Резонансная структура 2 ацетил-катиона вносит, по-видимому, значительный вклад в его стабилизацию. Однако (и это уже отмечалось в т. I, разд. 1.12.3) представлять ацетилирующий агент такой структурой вряд ли обоснованно. В структуре 2 и атом углерода, и атом кислорода карбонильной группы имеют по октету электронов, но не имеют вакантных орбиталей. Вследствие этого структура 2, в целом, не может выполнять функции электрофильного агента.
Внутримолекулярное ацилирование по Фриделю–Крафтсу также имеет препаративное значение. Для этой цели применяют или стандартную методику ацилирования с участием ацилгалогенида и кислоты Льюиса, или нагревание соответствующей карбоновой кислоты в полифосфорной кислоте (ПФК):
(CH2)3COCl
AlCl3 H3O 
|
4-фенил- |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||
бутаноилхлорид |
|
|
|
|
|
||||
|
α-тетралон (90%) |
||||||||
|
|
|
|||||||
|
(CH2)3COOH |
|
|
|
|
|
|
|
|
|
4-фенил- |
ПФК |
|
|
|
|
|||
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||
бутановая кислота |
|
|
|
||||||
|
α-тетралон (80%) |
||||||||
|
|
|
|||||||
Для построения нового шестичленного цикла, сконденсированного с бензольным циклом (аннелирование), используют ангидрид янтарной кислоты и его производные.
CH3 |
|
|
|
|
CH O |
||||||
|
|
O |
3 |
|
|
|
|||||
|
|
|
|
|
|||||||
|
|
CH3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||||
|
+ |
O |
AlCl3 H3O |
|
|
|
|
H2/Pd |
|||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||
CH3 |
O |
HOOC CH3 |
|||||||||
CH |
|||||||||||
|
|
|
|
||||||||
|
|
|
|
|
|
3 |
|
|
|
||
п-ксилол |
метилянтарный |
2-метил-4-(2',5'-диметилфенил)- |
|
ангидрид |
4-оксобутановая кислота |
9.2. Наиболее важные реакции |
|
|
|
67 |
||||||
|
|
CH3 |
|
CH3 |
4 |
|||||
|
|
|
|
|
|
5 |
|
|||
|
|
|
|
|
6 |
|
|
3 |
||
|
|
|
|
|
|
|
|
2 |
||
|
|
|
|
t° |
7 |
|
|
|||
|
|
|
|
|
|
|||||
|
|
HOOC CH3 |
|
|
|
|
1 CH3 |
|||
|
|
|
8 |
|
|
|
||||
|
|
|
|
|
|
|||||
|
|
CH3 |
|
CH3 |
O |
|||||
|
2-метил-4-(2',5'-диметилфенил)- |
|
2,5,8-триметил- |
|||||||
|
|
бутановая кислота |
|
1-тетралон |
||||||
В отличие от алкилирования ацилирование по Фриделю–Крафтсу не сопровождается побочными процессами (изомеризация, полизамещение).
Причиной отсутствия изомеризации ацилирующего агента является высокая резонансная стабилизация ацилий-иона по сравнению с любым другим ионом, который мог бы образоваться за счет 1,2-сдвига гидрид-иона или алкильной группы. Благодаря отсутствию процессов изомеризации при ацилировании легко могут быть получены алкилбензолы, труднодоступные прямым алкилированием. С этой целью жирно-ароматические кетоны, полученные в реакции ацилирования, подвергают затем восстановлению по одной из следующих реакций:
а) действием амальгамированного цинка в концентрированной HCl (реакция Клемменсена, 1913 г.);
б) действием гидразина в присутствии гидроксида калия (реакция Киж- нера–Вольфа, 1911 г.) при нагревании в высококипящем спирте (диэтилен-
гликоль или триэтиленгликоль):
|
|
|
|
CH2CH2CH3 |
|
|
O CH2CH3 |
a) Zn(Hg)/HCl |
|
+ ZnCl2 |
+ Hg |
||
|
||||||
|
|
|||||
|
|
|
|
|||
C |
пропилбензол (90%) |
|
||||
|
|
|
|
|||
|
|
|
б) NH2NH2 + KOH |
CH2CH2CH3 |
|
|
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
|
|
|
пропиофенон |
|
+ N2 |
|
|||
|
|
|||||
|
|
|
175 °C |
|
|
|
|
|
|
|
|
||
пропилбензол (85%)
н-Пропилбензол. Пропиофенон (25 г; 0,19 моль) и амальгамированный цинк (100 г; 1,53 моль) нагревают в течение 4 ч в смеси равных частей технической соляной кислоты и воды. Через 5 мин после смешения реагентов начинается бурная реакция. В ходе нагревания время от времени к реакционной смеси добавляют конц. HCl. Продукт экстрагируют хлороформом и выделяют перегонкой, т. кип. 155–160 °С. Выход 20,5 г (90%).

68 |
Глава 9. Электрофильное замещение в ароматическом ряду |
Оценивая синтетические возможности реакций алкилирования и ацилирования, следует иметь в виду следующие ограничения:
1.Алкилирование ароматических углеводородов по Фриделю–Крафтсу сопровождается процессами изомеризации электрофильного агента, а также побочными процессами полиалкилирования.
2.И в реакцию алкилирования, и в реакцию ацилирования по Фриде- лю–Крафтсу не вступают соединения, имеющие в кольце сильные электроноакцепторные заместители. Помимо дезактивирования бензольного кольца к электрофильной атаке эти заместители способны к комплексо-
образованию с AlCl3. По той же причине реакцию Фриделя–Крафтса не применяют также для анилина, фенола и подобных им соединений (основания Льюиса). Наличие НЭП на гетероатомах в этих соединениях ведет к связыванию катализатора — молекулы хлорида алюминия — и тем самым к его дезактивированию.
3.И арил-, и винилгалогениды не применяют в реакциях Фриде- ля–Крафтса, поскольку они в этих условиях не способны к образованию карбокатионов:
|
C6H5Cl |
|
реакция не идет |
||
AlCl3 |
|
|
|
|
|
|
C |
|
C |
Cl |
реакция не идет |
|
|
||||
|
|
||||
|
|
|
|
||
|
|
|
|
|
|
В связи с указанными ограничениями следует обратить внимание на новые ацилирующие агенты — ацилпроизводные трифторметансульфоновой кислоты (ацилтрифлаты). Эти соединения представляют собой смешанные ангидриды карбоновых кислот и трифторметансульфоновой кислоты и обладают высокой активностью. Они способны, например, ацилировать бензол в отсутствие какого-либо катализатора:
C6H6 + CF3SO2OCOCH3  C6H5COCH3 + CF3SO3H
C6H5COCH3 + CF3SO3H
бензол |
ацетилтрифтор- |
ацетофенон |
трифторметан- |
|
метансульфонат |
|
сульфоновая кислота |
9.3.ПРАВИЛА ОРИЕНТАЦИИ
В молекуле бензола все шесть атомов углерода равноценны. Вследствие этого не имеет значения, какой атом водорода подвергается замещению. Если бензольное кольцо содержит заместитель X, то положения, остающиеся свободными, неравноценны, в том числе по отношению к реакциям
9.3. Правила ориентации |
69 |
SEAr. В общем случае электрофильное замещение в монозамещенном бензоле может протекать в трех направлениях:
|
|
|
X |
|
|
|
|
|
E |
|
|
|
|
орто-замещение |
|
|
|
|
|
|
|
|
|
|
X |
|
X |
||
|
+ E |
|
|
мета-замещение |
|
|
|
||
|
|
|
||
|
|
|
|
E |
монозамещенный |
|
X |
||
бензол |
|
|||
|
|
|
|
пара-замещение |
|
|
|
|
|
E
дизамещенные бензолы
При рассмотрении этих реакций следует обсудить два важных вопроса:
1)какие изомеры преимущественно образуются в результате замещения,
т.е. каково ориентирующее влияние заместителя X?
2)в каком случае скорость реакции выше: когда реагентом является бен-
зол или замещенный бензол С6Н5Х, т. е. какова относительная реакционная способность (относительная скорость реакции)
kотн = kC6H5X/kC6H6
соединения С6Н5Х?
Если бы заместитель Х не изменял реакционную способность свободных положений в C6H5X, результаты электрофильного замещения в C6H5X определялись бы статистическим фактором, согласно которому молекула бензола имеет шесть положений для атаки электрофила E , а молекула C6H5X — только пять. При этом kотн равнялась бы 5/6. Соотношение орто-, мета- и пара-изомеров в этом случае составило бы 2 : 2 : 1:
X |
|
|
X |
X |
X |
|
|
|
|
|
E |
|
|
|
+ E |
|
|
|
+ |
|
|
|
|
+ |
|
||
|
|
|
||||
|
|
|
|
|
E |
|
|
40% |
40% |
E 20% |
|||
70 |
Глава 9. Электрофильное замещение в ароматическом ряду |
Ниже приведены экспериментальные результаты нитрования толуола, хлорбензола и нитробензола нитрующей смесью в стандартных условиях (табл. 9.1). Как видно из данных этой таблицы, учет только статистического фактора недостаточен для объяснения экспериментальных результатов нитрования.
Если в качестве заместителей выступают метильная группа и атом хлора, при нитровании образуются в основном орто- и пара-изомеры. Поэтому метильную группу и атом хлора следует рассматривать как орто,пара-ори- ентанты. Если же в исходном соединении имеется группа NO2, то новая нитрогруппа вступает преимущественно в мета-положение. Нитрогруппа является мета-ориентантом.
Кроме того, скорость нитрования толуола, например, в 24 раза выше скорости нитрования бензола (kотн). Напротив, при наличии хлора в бензольном кольце реакционная способность соединения в нитровании ниже (kотн = = 0,033), чем реакционная способность бензола. Нитробензол нитруется значительно труднее, чем бензол и хлорбензол.
Определяющее влияние заместителя на результаты реакции SEAr характерно практически для всех реакций электрофильного ароматического замещения. По своему влиянию на ориентацию в этих реакциях все заместители делятся, таким образом, на орто,пара- и мета-ориентанты. При этом заместители в бензольном кольце по отношению к реакциям электрофильного ароматического замещения могут выступать или как активирующие, или как дезактивирующие. (В разд. 9.5 можно познакомиться с количественной оценкой такого влияния.)
Таблица 9.1. Результаты нитрования ряда замещенных бензолов С6H5X нитрующей смесью
Х |
Выход изомерных нитросоединений, % |
|||
|
|
|
kотн |
|
орто- |
мета- |
|
||
|
пара- |
|||
СН3 |
58 |
4 |
38 |
24 |
|
Сl |
|
30 |
следы |
~70 |
0,033 |
NO |
2 |
1 |
98 |
1 |
~10–7 |
|
|
|
|
|
|
