
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf9.2. Наиболее важные реакции |
51 |
Реакции электрофильного ароматического замещения, как правило, описываются кинетическим уравнением второго порядка:
w= d[ArE]/dτ = k2[E ][ArH].
Всоответствии с этим уравнением можно было бы ожидать, что скоростьлимитирующей стадией большинства реакций электрофильного замещения является стадия образования σ-комплекса. Однако, поскольку стадия 4 — реароматизация — описывается тем же кинетическим уравнением, решение вопроса о скоростьлимитирующей стадии требует дополнительных данных. Такие данные получают, в частности, при изучении
кинетического изотопного эффекта реакции.
Кинетический изотопный эффект (КИЭ) измеряют как отношение константы скорости реакции обычного соединения к константе скорости реакции аналогичного соединения, но содержащего иной изотоп замещаемого
атома, например: kH/kD; kH/kT; k12С/k14С.
Для веществ, меченных дейтерием или тритием, различие в скоростях реакций по сравнению с соединениями, содержащими протий, особенно велико вследствие большого различия в массах этих изотопов (1 : 2 или 1 : 3). В тех случаях, когда kH/kD или kH/kT равно 10–20, говорят, что кинетический изотопный эффект наблюдается. Наличие КИЭ указывает на то, что стадия разрыва связи С–H (стадия 4), по крайней мере частично, влияет на скорость всей реакции.
В тех случаях, когда kH/kD или kH/kT равно 1, говорят, что кинетический изотопный эффект отсутствует. В этих реакциях стадия образования σ-комплекса является скоростьлимитирующей. Многие реакции электрофильного замещения в ароматическом ряду не обнаруживают КИЭ.
9.2.НАИБОЛЕЕ ВАЖНЫЕ РЕАКЦИИ
Реакции электрофильного замещения в ароматических соединениях имеют огромное значение и в промышленности, и в лабораторной практике. Их изучение мы начинаем с рассмотрения наиболее важных реакций электрофильного ароматического замещения в бензоле.
9.2.1.Галогенирование бензола
Замещение атома водорода в молекуле арена на галоген является одним из методов получения хлор- и бромзамещенных ароматических соединений.
Выше в качестве общей схемы механизма реакций электрофильного ароматического замещения мы уже рассмотрели механизм бромирования бензола в присутствии бромного железа в качестве катализатора. На практике
52 |
Глава 9. Электрофильное замещение в ароматическом ряду |
вкачестве катализатора при галогенировании применяют, как правило, железные стружки. Катализатор в таком случае образуется непосредственно
вреакционной массе при взаимодействии железных стружек с галогеном.
Бромбензол. Бром (60 г; 0,38 моль) медленно прибавляют к смеси бензола (33 г; 0,42 моль) и железных стружек (2 г; 0,036 моль). Смесь слегка нагревают до исчезновения окраски брома (~1 ч). Добавляют воду, органический слой отделяют, промывают и сушат. Продукт выделяют перегонкой, т. кип. 156 °С. Выход 48 г (85%).
Так же проводят и хлорирование бензола:
Fe
+ Cl2 25 °C
Cl
+ HCl
бензол |
хлорбензол |
Механизм хлорирования бензола включает следующие стадии:
Стадия 1 — образование электрофильного агента. Комплексообразование с кислотой Льюиса ведет к появлению частичного или целого положительного заряда на одном из атомов в молекуле хлора.
3Cl2 + 2Fe  2FeCl3,
2FeCl3,
Cl |
|
Cl |
+ FeCl3 |
|
|
|
Cl |
|
Cl |
|
FeCl3 |
|
|
|
|
|
|
|
Cl FeCl4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
основание |
кислота |
|
|
|
|
|
ДАК |
|
|
|
|
|
|
ионная пара |
|
|
|
|
||||||
Льюиса |
Льюиса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
+ |
|
|
FeCl4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлороний- |
|
|
тетрахлор- |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ион |
|
феррат-ион |
|||
Стадия 2 — взаимодействие с молекулой бензола. И донорно-акцепторный комплекс, и ионная пара, и хлороний-ион могут выступать при этом в качестве электрофильного агента.
H
+ Cl



 Cl
Cl
медленно
Cl
FeCl4 |
|
+ FeCl3 |
+ HCl |
|
быстро |
||||
|
|
|||
Галогенирование ароматических углеводородов в присутствии кислот Льюиса отличается тем, что вступающий атом галогена лишь незначительно дезактивирует ароматическое ядро для последующей электрофильной атаки. В частности, при хлорировании бензола в присутствии кислот Льюиса побочно получают о- и п-дихлорбензолы, а также 1,2,4-трихлорбензол.

9.2. Наиболее важные реакции |
53 |
Продукты полигалогенирования образуются в большей степени, если в качестве катализатора применяют галогениды алюминия.
Cl |
Cl2/AlCl3 |
|
Cl |
|
Cl |
|
|
|
|
+ |
|
||
|
|
|
||||
|
—HCl |
|
|
|
|
|
|
|
|
|
|
||
Cl Cl
Cl2/AlCl3
—HCl
хлорбензол |
о-дихлорбензол |
п-дихлорбензол |
Cl
Cl  Cl
Cl
1,2,4-трихлорбензол
Интересно, что эффективный галогенирующий агент может образоваться при взаимодействии галогена не только с кислотой Льюиса, но и с основанием Льюиса. Таким агентом является, например, ион бромпиридиния.
|
Br |
|
|
N |
N |
|
|
Br—Br + |
|
|
|
|
ион бромпиридиния |
|
|
Br |
|
|
|
N |
H |
|
|
Ar—H + |
Ar—Br + C5H5NH |
||
Ar N |
|||
|
Br |
|
Свойства пиридина как хорошей уходящей группы в значительной мере обеспечивают успех применения этого бромирующего агента (подробнее о свойствах уходящих групп см. в разд. 13.4.1).
По-видимому, то же справедливо и для объяснения эффективности ацилгипогалогенитов в качестве агентов электрофильного галогенирования аренов.
O |
|
|
H |
|
|
|||
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Ar—H |
|
Ar R–COO |
|
Ar—Br + R–COOH |
R |
O |
|
|
|||||
|
|
|
|
|
||||
|
|
|
Br |
|
|
|||
|
|
|
|
|
|
|
|
|
Ацилат-ионы также оказываются хорошими уходящими группами.
54 |
Глава 9. Электрофильное замещение в ароматическом ряду |
В растворе галогена и ацетата ртути, например, образуется эффективный галогенирующий агент — ацетилгипогалогенит (гипогалит уксусной кислоты):
Hg(OCOCH3)2 + X2 |
|
XHgOCOCH3 + CH3COOX |
|
||
|
|
ацетилгипогалогенит |
Особенно реакционноспособны трифторацетилгипогалогениты. Трифторацетилгипобромит, например, легко бромирует бензол и его производные, в том числе нитробензол в отсутствие катализаторов.
|
|
|
|
|
|
Br |
|
|
|
|
O |
|
|
|
|
||
|
|
+ CF3C |
|
|
|
+ CF3COOH |
||
|
|
|
|
|
||||
|
|
O |
|
Br |
|
|
|
трифтор- |
|
|
|
|
|
|
|||
бензол |
трифторацетил- |
|
бромбензол |
уксусная кислота |
||||
|
|
|||||||
|
|
гипобромит |
|
|
|
|
||
Прямое фторирование и иодирование бензола проводят крайне редко. Фторирование является исключительно активным процессом и трудным для контроля. Иодирование, напротив, протекает очень медленно. Реакцию, однако, можно осуществить, проводя ее в присутствии окислителя.
Вкачестве окислителя можно применять, например, азотную кислоту.
Вэтих условиях генерируются иодоний-ионы, которые и выступают в качестве электрофильных агентов.

 I
I
HNO3
+ I2
бензол |
иодбензол (85%) |
Аналогично хлорированию и бромированию иодирование можно проводить также ацетил- и трифторацетилгипоиодитами.
9.2.2.Сульфирование бензола
Сульфированием называют реакцию замещения атома водорода в углеводороде на сульфогруппу –SO3H.
|
|
|
|
|
SO3H |
+ H2SO4 (конц.) |
|
t |
|
|
+ H2O |
|
|
|
|||
|
|
|
|
||
|
|
|
бензол |
бензолсульфокислота |
9.2. Наиболее важные реакции |
55 |
Существенным отличием реакции сульфирования от других реакций электрофильного замещения является ее обратимость; при этом скорость обратной реакции — десульфирования — возрастает по мере снижения концентрации сульфирующего агента. В промышленности обратимость сульфирования устраняют непрерывной отгонкой образующейся воды из реакционной массы, добиваясь практически полного использования серной кислоты.
Электрофильным агентом в сульфировании концентрированной серной кислотой и моногидратом выступает нейтральная молекула серного ангидрида SO3. Полагают, что сульфирование идет по следующей схеме.
Стадия 1 — образование электрофильного реагента:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||
H2 SO4 |
+ HO |
|
S OH |
|
|
|
|
|
|
|
|
|
H |
|
O |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
OH + HSO4 |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
H O |
|||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
H |
|
|
|
|
O |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
+ H2O |
|||||||||||||||
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
S |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
H O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O δ |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
OH |
|
+ HSO4 |
|
|
|
|
|
|
|
|
|
δ S |
|
Oδ |
|
|
|
+ H2SO4 |
||||||||||||||||||
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O δ |
|
|
|
|
|
|||||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Стадия 2 — образование σ-комплекса: |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
+ S |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
медленно |
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
σ-комплекс
Стадия 3 — выброс протона с образованием продукта замещения идет с участием основания — гидросульфат-иона HSO4 :
H |
|
|
|
|
|
O |
|
|
O |
|
|
|
|
S |
|
||
|
|
|
|
|
|
|||
S |
HSO4 |
|
O |
+ H2SO4 |
||||
|
||||||||
O |
|
|
|
|
O |
|||
быстро |
||||||||
|
|
|
|
|||||
O |
|
|
|
|
|
|
||
|
O |
|
|
|
|
O |
|
|
S |
|
|
|
|
|
S |
|
|
|
O |
H2SO4 |
|
O |
+ HSO4 |
|||
|
|
|||||||
O |
|
|
OH |
|||||
|
|
|
|
|
||||
|
быстро |
|
|
|||||
|
|
|
|
|
||||
56 |
Глава 9. Электрофильное замещение в ароматическом ряду |
Реакция сульфирования отличается небольшим кинетическим изотопным эффектом, kH/kD 2. Этот факт, по-видимому, объясняется большей стабильностью соответствующего промежуточного σ-комплекса. σ-Ком- плекс в этой реакции представляет собой биполярный ион, в котором скомпенсированы положительный и отрицательный заряды. Тем самым стадия отщепления протона от такого σ-комплекса (стадия 3) несколько замедляется.
Кроме купоросного масла (94%-я серная кислота) и моногидрата (100%-я серная кислота) для сульфирования аренов применяют и другие сульфирующие агенты: олеум — раствор SO3 в H2SO4, комплексы SO3–диоксан, SO3–пиридин, пары′ SO3 с нейтральным газом (например, азотом), хлорсульфоновая кислота HSO3Cl.

 SO3H
SO3H
+ SO3
бензол бензолсульфокислота
|
|
|
|
|
SO3H |
|
SO2Cl |
|
+ HSO3Cl |
|
|
|
HSO3Cl |
|
|
|
|
|
|
|
|||
|
–HCl |
|
|
–H2SO4 |
|
|
|
|
|
|
|
||||
бензол |
бензолсульфокислота |
бензолсульфохлорид |
|||||
Преимуществом этих сульфирующих агентов является исключение обратной реакции десульфирования.
9.2.3.Нитрование бензола
Нитрование заключается в замещении атома водорода бензольного кольца на нитрогруппу NO2. Бензол реагирует с концентрированной азотной
кислотой медленно даже при нагревании. Поэтому нитрование чаще всего проводят действием более активного нитрующего агента — нитрующей
смеси — смеси концентрированных азотной и серной кислот. Нитрование аренов нитрующей смесью является основным способом получения нитросоединений ароматического ряда.
HNO3(конц.) |
|
NO2 |
||
|
+ H2O |
|||
|
|
|
||
H2SO4 (конц.) |
||||
|
||||
бензол |
нитробензол |
9.2. Наиболее важные реакции |
57 |
Нитрование бензола нитрующей смесью проводят при 45–50 °С. Поскольку реакция нитрования необратима, азотную кислоту применяют в минимальном избытке (5–10%), добиваясь практически полного превращения бензола.
Нитробензол. К бензолу (65 г; 0,83 моль) при хорошем размешивании постепенно прибавляют смесь конц. H2SO4 (110 мл) и конц. HNO3 (85 мл; 0,87 моль) таким образом, чтобы температура смеси не превышала 50 °С. По окончании реакции (через 1 ч после смешения реагентов) смесь охлаждают, продукт отделяют, промывают водой, сушат и перегоняют, т. кип. 209–210 °С. Выход 92 г (90%).
Серная кислота в составе нитрующей смеси необходима для повышения
концентрации электрофильного агента — нитроний-иона NO
2.
Реакция нитрования идет по следующей схеме.
Стадия 1 — образование электрофильного агента: |
|
||||
|
O |
|
|
O |
|
H O N |
|
+ H2SO4 |
H O N |
|
+ HSO4 |
|
O |
|
быстро |
O |
|
|
|
H |
|
||
|
|
|
|
|
|
|
O |
|
|
|
|
H O N |
|
H2O + O N O |
|
O N O |
|
|
O |
быстро |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
Нитроний-катион имеет линейную структуру с sp-гибридизованным атомом азота; он изоэлектронен молекуле СО2.
Стадия 2 — образование σ-комплекса: |
|
|||||||
|
|
O |
|
|
H |
O |
||
|
|
|
|
|
||||
|
+ |
|
|
|
|
|
N |
|
|
N |
|
|
|
|
|||
|
медленно |
O |
||||||
|
|
|
|
|
||||
O
Стадия 3 — выброс протона с образованием продукта замещения:
H |
O |
|
NO2 |
|
|
|
|||
N |
|
HSO4 |
|
+ H2SO4 |
|
быстро |
|
||
|
O |
|
|
|
Кинетический изотопный эффект в реакциях нитрования обычно отсутствует, так как kH/kD 1. В соответствии с этим стадию образования σ-ком- плекса следует считать скоростьлимитирующей.
58 |
Глава 9. Электрофильное замещение в ароматическом ряду |
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Схемы механизмов органических реакций, которые приводятся в учебниках, не следует рассматривать как абсолютно доказанные и универсальные. Дело в том, что при обсуждении каждой конкретной схемы автор, ограниченный объемом учебника, вынужден ее формулировать таким образом, чтобы она объясняла возможно большее число известных к настоящему времени экспериментальных фактов. При этом за рамками учебника остается большое число фактов, которые во многих случаях способны углубить обсуждаемые схемы, а в ряде случаев и показать, что некоторые вопросы механизма остаются все еще неясными.
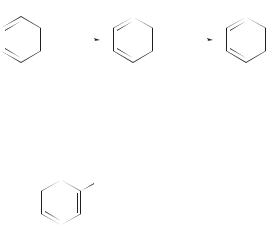
Вывод о том, что кинетический изотопный эффект в реакциях нитрования аренов обычно отсутствует, следует обсудить подробнее. Существуют примеры нитрования ароматических соединений, которые имеют значения КИЭ, заметно отличные от единицы. Например, нитрование антрацена комплексом NO2BF 4, которое также протекает по схеме электрофильного ароматического замещения, имеет заметный КИЭ, причем его величина зависит от растворителя. В диметилсульфоксиде отношение kH/kD найдено равным 2,6, а в ацетонитриле это отношение достигает величины 6,1.
H
kH
+ NO2BF4
kD
D
9-дейтероантрацен
H NO2 NO2
D D
9-дейтеро-10-нитроантрацен
H
D NO2 |
NO2 |
|
9-нитроантрацен
9.2. Наиболее важные реакции |
59 |
Диметилсульфоксид — более сильное основание, чем ацетонитрил. Он ускоряет стадию отрыва протона, снижает тем самым вклад этой стадии в определение скорости всего процесса, что и отражается в сравнительно невысокой величине КИЭ (2,6). Ацетонитрил, будучи слабым основанием, не способен ускорять стадию отрыва протона от σ-комплекса. Именно эта стадия в значительной мере начинает определять скорость всей реакции, чему и соответствует повышенное значение КИЭ (6,1).
При применении двукратного количества нитрующего агента и более жестких условий (повышенная температура, более концентрированная нитрующая смесь) получают м-динитробензол:
|
|
|
NO2 |
|
NO2 |
||||
|
|
HNO3 |
|
|
HNO3 |
|
|
||
|
|
|
|
||||||
|
|
H2SO4 |
|
|
|
H2SO4 |
|
|
NO2 |
бензол |
нитробензол |
|
|||||||
|
|
|
|
||||||
|
|
м-динитробензол |
|||||||
В этих условиях становятся заметными окислительные процессы. В частности, отмечено образование в качестве примеси 1,3-дигидрокси-2,4,6- тринитробензола (стифниновая кислота).
NO2
OH
O2N NO2
OH
стифниновая кислота
Применяют и другие нитрующие агенты: концентрированную азотную кислоту, соли нитрония (NO2BF 4, NO2SbF 6), ацетилнитрат CH3COONO2, представляющий собой смешанный ангидрид азотной и уксусной кислот.
Задача 9.1. Имея ввиду, что рКа серной кислоты равно –5,0, а рКа азотной кислоты равно –1,4, объясните, почему нитрование протекает более быстро в смеси концентрированных азотной и серной кислот, нежели, чем в концентрированной азотной кислоте.
9.2.4.Алкилирование по Фриделю–Крафтсу
Замещение атома водорода на алкильную группу проводят, как правило, действием алкилирующего агента в присутствии кислот Льюиса. В качестве алкилирующего агента обычно применяют галогеналкан (хлорили бромалкан), а в качестве катализатора — хлорид или бромид алюминия. Реакцию ведут, как правило, в избытке бензола.
60 |
Глава 9. Электрофильное замещение в ароматическом ряду |
Реакция алкилирования по Фриделю–Крафтсу является методом получения алкилбензолов — гомологов бензола.
RCl
AlCl3
R
+ HCl
бензол |
алкилбензол |
Алкилирование идет по следующей схеме:
Стадия 1 — образование электрофильного агента, например, при взаимодействии хлоралкана с AlCl3, протекает аналогично активированию молекулы хлора комплексообразованием с кислотой Льюиса:
R Cl + AlCl3 |
R Cl AlCl3 |
R [AlCl4] |
|
ДАК |
ионная пара |
R + AlCl4
+ AlCl4
карботетрахлоркатион алюминат-
ион
Стадия 2 — образовавшийся электрофил — ДАК, ионная пара или карбокатион — реагирует далее с ареном, давая промежуточный σ-комплекс:
|
H |
медленно |
быстро |
+ R [AlCl4] |
R AlCl4 |
бензол |
σ-комплекс |
R
+ HCl + AlCl3
алкилбензол
Отщепление протона из σ-комплекса ведет к образованию продукта замещения.
Факт образования карбокатионов в составе ионных пар или в свободном виде подтверждается тем, что реакции алкилирования сопровождаются перегруппировками электрофильного агента, в результате чего, например,
