Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
19.5. Спектральный анализ альдегидов и кетонов |
501 |
Масс-спектры. Фрагментация молекулярных ионов карбонильных соединений RCOX (X = H, R, OR, NH2, NR2) в масс-спектрах протекает по следующим направлениям (см. разд. 12.6):
1) α-распад — разрывы связи С–Х [пути (1а) и (1б)] и связи С–С [пути (1в) и (1г)]
|
|
|
|
|
|
|
|
|
|
|
X |
+ |
R |
|
|
C |
|
|
O |
|
R |
|
C |
|
O |
|
|
R (1a) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–CO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1б) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
R |
|
|
|
X |
+ |
R |
C |
|
|
O |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
C |
|
X |
|
|
|
|
R |
+ |
O |
|
C |
|
|
|
X |
|
|
|
|
|
|
|
|
(1в) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
R |
+ |
O |
|
C |
|
|
|
X |
|
|
|
|
|
|
|
|
(1г) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2) перегруппировка Мак-Лафферти |
|
|
||||||||||||||
R |
H |
|
|
|
|
|
|
R |
H |
|
|
|||||
H |
|
C |
O |
|
|
|
O |
|||||||||
|
|
|
|
|
|
|
+ |
|
||||||||
|
|
|
|
|
|
|
|
|
H |
|
C |
|
|
|
||
H2C |
|
C |
|
|
|
|
||||||||||
|
|
|
|
|
|
H |
C |
|||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
C |
|
|
X |
|
H2C |
C |
|
X |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
H H |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
H |
|
|
||||||
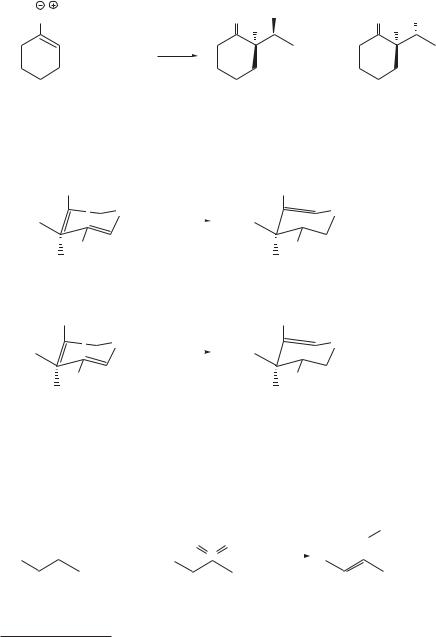
Вмасс-спектрах простых альдегидов и кетонов пики молекулярных ионов весьма интенсивны. С увеличением углеродной цепи их интенсивность снижается. Наиболее интенсивными становятся пики осколочных ионов,
образующихся при α-распаде молекулярного иона, М – 1 [путь (1а)] и СНО [m/z 29, путь (1в)], М – СНО [путь (1г)]. Если в альдегиде имеются четыре и более атомов углерода, то в масс-спектре наблюдается интенсив-
ный пик иона m/z 44 (R = H), 58 (R = CH3), 72 (R = C2H5) и т. д. Его появление обусловлено перегруппировкой Мак-Лафферти.
Вмасс-спектрах кетонов R1–CO–R2 наблюдаются интенсивные пики осколочных ионов R1CO и R2CO [m/z 43 (R = CH3), 57 (R = C2H5), 71 (R = C3H7) и т. д., пути (1а) и (1в)], пики ионов R1 и R2 [m/z 15, 29, 43 и
т.д., пути (1б) и (1г)]. Перегруппировка Мак-Лафферти приводит к образованию перегруппировочных ионов m/z 58, 72, 86 и т. д.
Вмасс-спектре 3-метил-2-пентанона наблюдается пик молекулярного ио-
на m/z 100. При α-распаде С–С-связи в молекулярном ионе образуются оско-
лочные ионы m/z 85 (C4H9CO ) и 43 (CH3CO ) [пути (1а) и (1в)], осколочный ион m/z 57 (C4H9 ) [пути (1б) и (1г)]. При перегруппировке Мак-Лафферти возникает перегруппировочный ион m/z 72 [CH3–CH=C(OH)–CH3] .
Задача 19.11. Определите строение соединения С4Н8О, которое в ИК-спектре имеет интенсивную полосу поглощения при 1725 см–1, а в спектре ПМР наблюдается три резонансных сигнала: δ1 1,12 м. д. (триплет, 3Н), δ2 2,15 м. д. (синглет, 3Н) и δ3 2,66 м. д. (квадруплет, 2Н).
502 |
Глава 19. Альдегиды и кетоны |
НАИБОЛЕЕ ВАЖНЫЕ ПРЕДСТАВИТЕЛИ
Формальдегид (метаналь) НСНО получают окислительным дегидрированием метанола в присутствии воздуха над катализатором Ag, окислением метанола над Fe/Mo-ката- лизатором, а также из синтез-газа. Бесцветный газ, т. кип. –19 °С, обладает резким запахом; хорошо растворим в воде, спиртах, умеренно — в бензоле, диэтиловом эфире, хлороформе. Применяют в производстве фенолоформальдегидных смол, синтетического каучука и лекарственных средств. Для удобства хранения, транспортировки и применения выпускают в виде 37–40%-го водного раствора (формалин) и
твердого полимера (параформ). Антисептическое средство. ПДК 0,05 мг/м3. Ацетальдегид (этаналь) СН3СНО получают окислением этилена и гидратацией ацетиле-
на. Кипит при комнатной температуре (20,2 °С); смешивается с водой и органическими растворителями. Имеет резкий опьяняющий запах. Применяют в производстве уксусной кислоты, уксусного ангидрида, этилацетата, хлораля CCl3CHO. В присутствии минеральных кислот образует жидкий тример (паральдегид) и твердый тетрамер (метальдегид). ПДК 5 мг/м3.
Ацетон (пропанон) СН3СОСН3 получают гидратацией пропилена с последующим дегидрированием изопропанола, а также при производстве фенола кумольным методом. Бесцветная жидкость, т. кип. 56,2 °С; смешивается с водой и органическими растворителями. Применяют в производстве метилметакрилата, метилизобутилкетона, метакриловой кислоты, лекарственных средств, душистых веществ; в качестве растворителя ацетата целлюлозы, синтетических полимерных материалов; в процессах
органического синтеза. ПДК 200 мг/м3.
Циклогексанон С6Н10О получают окислением циклогексана, гидрированием фенола, окислением или дегидрированием циклогексанола. Бесцветная жидкость, т. кип. 155,6 °С; растворяется в воде (7%), в органических растворителях. Применяют в производстве адипиновой кислоты, ε-капролактама, L-лизина; в качестве растворителя нитратов и ацетатов целлюлозы, жиров, восков. Раздражает слизистые оболочки глаз и кожу. ПДК 10 мг/м3.
Камфора (1,7,7-триметилбицикло[2.2.1]гептанон-2) С10Н16О. Выделяют из древесины камфорного дерева [D-(+) камфора], из эфирного масла сибирской пихты [L-(–) камфора] или получают синтетически из L-пинена [(±) камфора]. (+)-Камфора — бесцветные кристаллы, т. пл. 178,5–179,5 °С; растворяется в органических растворителях. Применяется в производстве лекарственных средств, а также в качестве пластификатора нитратов и ацетатов целлюлозы.
Акролеин (пропеналь) СН2=СНСНО получают окислением пропилена воздухом. Бесцветная жидкость, т. кип. 52,7 °С, обладает невыносимым запахом; растворим в воде и органических растворителях. Склонен к полимеризации, в качестве стабилизатора к акролеину добавляют фенол или гидрохинон. Применяют в синтезе метионина, глицерина, акриловой кислоты, пиридина, лекарственных средств, а также для получения сополи-
меров с акрилонитрилом и метилметакрилатом. Т. самовоспл. 234 °С. ПДК 0,2 мг/м3. Бензальдегид С7Н6О получают каталитическим окислением толуола, из бензола и СО в
присутствии AlCl3 и HCl (реакция Гаттермана–Коха). Бесцветная жидкость с запахом горького миндаля, т. кип. 179,2 °С; растворяется в спирте, плохо — в воде. На воздухе быстро окисляется до бензойной кислоты. Применяют в парфюмерной и пищевой промышленности, в производстве арилметановых красителей. Раздражает
слизистые оболочки глаз и дыхательных путей.
Ацетофенон С8Н8О получают из бензола и ацетилхлорида в присутствии AlCl3 (реакция Фриделя–Крафтса). Бесцветная жидкость с запахом черемухи, т. кип. 202,3 °С; растворяется в органических растворителях, плохо — в воде. Применяют в парфюмерной промышленности. Раздражает слизистые оболочки глаз и дыхательных путей. ПДК 5 мг/м3.

Термодинамический и кинтеический контроль енолизации |
503 |
Для углубленного изучения!
ТЕРМОДИНАМИЧЕСКИЙ И КИНЕТИЧЕСКИЙ КОНТРОЛЬ. РЕГИО- И СТЕРЕОСЕЛЕКТИВНОСТЬ ЕНОЛИЗАЦИИ
Если кетон имеет два эквивалентных α-положения, от которых в присутствии подходящего основания могут отщепляться протоны, то преобладающее положение ионизации определяется условиями реакции и устойчивостью образующегося енолят-иона. При этом следует иметь в виду два граничных случая:
— ионизация является обратимой и сопровождается взаимопревращением двух изомерных форм енолятов А и Б; состав продуктов ионизации
(константа равновесия K) определяется их относительной устойчивостью — имеет место термодинамический контроль енолизации
|
|
|
|
|
O |
|
|
|
|
|||
|
|
|
|
R |
C=C |
|
—CH |
R' |
|
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
2 |
2 |
|
|
|
|
|||
|
|
|
|
|
A |
|
|
|
|
|||
|
O |
|
|
|
|
K |
|
[A] |
= K |
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||
R |
CH—C—CH |
—R' + B |
|
|
|
|
[Б] |
(1) |
||||
|
|
|
|
|
|
|||||||
2 |
2 |
|
|
|
|
|
|
|
|
|
||
O
R2CHC=CHR'
Б
— ионизация проводится в условиях, исключающих обратимость и взаимопревращение двух изомерных форм енолятов А и Б; состав продуктов
ионизации определяется относительными скоростями образования каждой из енольных форм — имеет место кинетический контроль енолизации
O
R2C=C—CH2R'
O ka  A [A] = ka [Б] kb
A [A] = ka [Б] kb
R |
CH—C—CH |
—R' + B |
O |
(2) |
||
2 |
2 |
|
|
|||
|
|
|
kb |
|
|
|
|
|
|
|
|
||
R2CHC=CHR'
Б
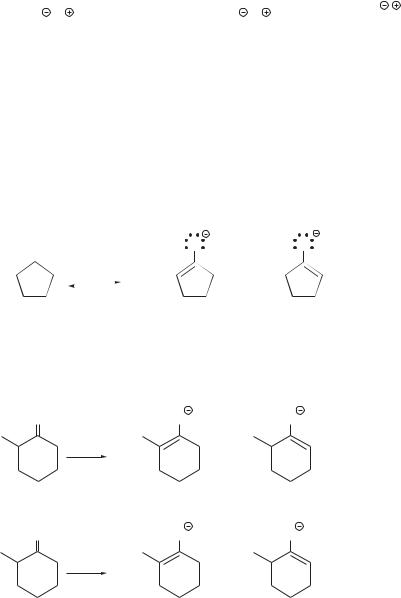
Термодинамическому контролю благоприятствуют спиртовые и водные растворы щелочей и повышенная температура. Если в α-положении к карбонильной группе исходного кетона имеется алкильная группа, то более устойчивым (а следовательно, и преобладающим среди продуктов енолизации) оказывается енолят с более замещенной двойной связью (как более замещенный алкен).
504 |
Для углубленного изучения |
Кинетическому контролю способствуют низкая температура, апротонный растворитель и применение очень сильных оснований — чаще всего литийдиизопропиламида (ЛДА), реже — литийбис(триметилсилил)амида или трифенилметида лития
(i-C |
H |
) |
N Li (ЛДА) |
(Me |
Si) |
N Li |
(C |
H |
) |
CLi |
3 |
7 |
2 |
|
3 |
2 |
|
6 |
5 |
3 |
|
Эти условия затрудняют взаимопревращение изомерных форм. При этом в апротонных растворителях становится благоприятным образование менее замещенного енолята — отрыв стерически менее затрудненного протона протекает быстрее. Применение иона лития в качестве противоиона в структуре енолята при этом особенно рекомендуется, поскольку ион лития тесно координируется по атому кислорода, снижая тем самым обратимость
енолизации. Именно условия кинетического контроля делают возможной
региоселективность енолизации [1–4].
Например, при ионизации 2-метилциклопентанона в спиртовых и водных щелочах в равновесной смеси находится около 94% енолята А и лишь 6% енолята Б, а при ионизации этого циклоалканона в кинетически-конт- ролируемых условиях содержание енолята Б достигает 72% [1]:
O |
|
|
O |
|
O |
||||
CH3 |
|
|
|
|
|
|
CH3 |
CH3 |
|
|
|
|
|||||||
|
|
|
|
|
(основание) |
+ |
|
||
2-метил- |
|
|
А: 94% |
Б: 6% |
— термодинамический |
||||
циклопентанон |
|
|
|
|
контроль |
||||
|
|
|
|
|
28% |
72% |
— кинетический |
||
|
|
|
|
|
|
|
|
|
контроль |
Не менее наглядны и другие примеры термодинамического и кинетического контроля [2–4]:
O |
|
O |
O |
CH3 |
CH3 |
|
CH3 |
кин. конт. (ЛДА–ДМЭ) |
|
1 |
99 |
терм. конт. (Et3N–ДМФА) |
|
78 |
22 |
O |
|
O |
O |
Ph |
Ph |
|
Ph |
кин. конт. (ЛДА–ТГФ, –70 °C) |
— |
единств. |
|
терм. конт. (KH–ТГФ) |
|
единств. |
— |

Направленные перекрестные альдольные конденсации |
505 |
||||||||
O |
O |
|
|||||||
СH3СH2СH2 |
|
|
|
CСH3 |
|
СH3СH2СH2 |
|
C=СH2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
||||
кин. конт. (ЛДА–ТГФ, –78 °C) |
единств. |
|
|||||||
Условия определяют не только регио-, но и стереоселективность енолизации [5]. Это положение является важным, прежде всего, для тех енолятов, которые могут существовать в виде двух стереоизомеров. Ниже приведены данные для ионизации 3-пентанона.
O |
CH3 |
O |
CH3 |
CH2CH3 |
|||
|
|
|
|
||||
СH3СH2 |
|
СCH2CH3 |
|
|
С=С |
|
С=С |
|
|
|
|
||||
3-пентанон |
H |
CH2CH3 |
H |
O |
|||
2,2,6,6-тетраметил- |
|
Z-енолят |
|
Е-енолят |
|||
|
|
|
|
||||
пиперидид лития, ТГФ, 0 °C |
|
14 |
|
86 |
|||
то же + ГМФТА |
|
92 |
|
8 |
|||
Следует отметить уникальные свойства гексаметилфосфортриамида (ГМФТА), добавление которого в минимальных количествах коренным образом меняет стереоселективность процесса. Аналогичные свойства проявляет тетраметилэтилендиамин (ТМЭДА). Оба растворителя способны к тесной координации с ионами лития.
НАПРАВЛЕННЫЕ ПЕРЕКРЕСТНЫЕ АЛЬДОЛЬНЫЕ КОНДЕНСАЦИИ
Перекрестные конденсации возможны и между различными карбонильными соединениями, каждое из которых имеет водород у α-углеродного атома. Эти конденсации имеют ряд особенностей. Применение термодинамически контролируемых условий ведет, как правило, к получению сложных смесей продуктов. По крайней мере, четыре различных альдоля в таких условиях могут образоваться в альдольной конденсации двух альдегидов, каждый из которых способен к альдольной конденсации.
OH R
RCH2CH CHCHO
OH R'
RCH2CHO + R'CH2CHO 
RCH2CH CHCHO
OH R
R'CH2CH CHCHO
OH R'
R'CH2CH CHCHO


Стереоселективные альдольные конденсации |
507 |
Более того, такой карбанион не только более устойчив вследствие отсутствия в нем дестабилизирующего влияния метильной группы (такое влияние имеется в карбанионе, образованном при ионизации метиленовой группы). По пространственным причинам, он является и более реакционноспособным в последующем нуклеофильном присоединении к карбонильной группе неионизированной молекулы ацетальдегида.
СТЕРЕОСЕЛЕКТИВНЫЕ АЛЬДОЛЬНЫЕ КОНДЕНСАЦИИ
Кинетически-контролируемые условия енолизации позволяют контролировать и стереоселективность направленной перекрестной альдольной конденсации. Особенно предпочтительны при этом еноляты лития. На-
пример, Z-енолят, образованный из 2,2-диметил-3-пентанона в кинети- чески-контролируемых условиях, дает с бензальдегидом более 98% цис- альдоля [6a,б].
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH |
|
||||
СH3 |
O |
|
|
O |
|
|
O |
|
|
|
3 |
|||||||||
|
|
|
|
|
||||||||||||||||
Ph |
|
|
|
Li |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
(CH3)3C |
|
Ph |
|||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
PhCHO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
С=С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–72 °C |
H H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H |
C(CH3)3 |
|
|
|
|
C(CH3)3 |
O |
OH |
||||||||||||
цис-альдоль (98%)
Этот стереохимический результат следует из циклического переходного состояния, имеющего конформацию «кресло». Стереоселективность заметно снижается, если заместители у СО-группы в кетоне близки по размерам и при повышении температуры.
O |
|
СH3 |
R |
СH3 |
|
OLi |
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
ЛДА |
С=С |
|
|
|
|
С=С |
|
PhCHO |
|||||||
СH3СH2СR |
|
|
|
+ |
||||||||||||||
|
H |
OLi |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
H |
|
|
R |
|
|
|||||||
|
|
|
|
|
E |
|
|
|
|
|
Z |
|
|
|
|
|
|
|
R = С(СH3)3: |
|
|
2 |
|
|
|
|
|
|
98 |
|
|
|
|
|
|
||
R = CH(CH3)2: |
|
|
40 |
|
|
|
|
|
|
60 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
O |
OH |
|
|
|
O |
OH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
Ph |
|
R |
|
Ph |
||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
транс- |
|
|
|
|
|
цис- |
|||||
R = С(СH3)3: |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
98 |
|
||
R = CH(CH3)2: |
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
82 |
|
||