
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
18.2. Циклические эфиры |
421 |
вым напряжением. Величина этого напряжения оценивается энергией в 105 кДж/моль (25 ккал/моль).
H H
H C0,150 нмC
C0,150 нмC H
H
61°
:O:0,145 нм
Эпоксиды являются более полярными соединениями, чем простые эфиры. Дипольный момент этиленоксида составляет значительную величину (1,88 D), что связано с полярностью связей С—О и небольшим углом С—О—С. Как и простые эфиры, эпоксиды характеризуются двумя реакционными центрами:
1)НЭП атома кислорода;
2)двумя полярными С—О-связями, разрыв одной из которых приводит
краскрытию эпоксидного цикла.
В общем, реакции эпоксидов аналогичны реакциям простых диалкиловых эфиров. Различие заключается в значительно более высокой реакционной способности эпоксидов, обусловленной напряжением трехчленного цикла.
Реакции
При действии на оксираны нуклеофильных реагентов протекают реакции с раскрытием эпоксидного цикла.
РЕАКЦИИ СО СЛАБЫМИ НУКЛЕОФИЛАМИ
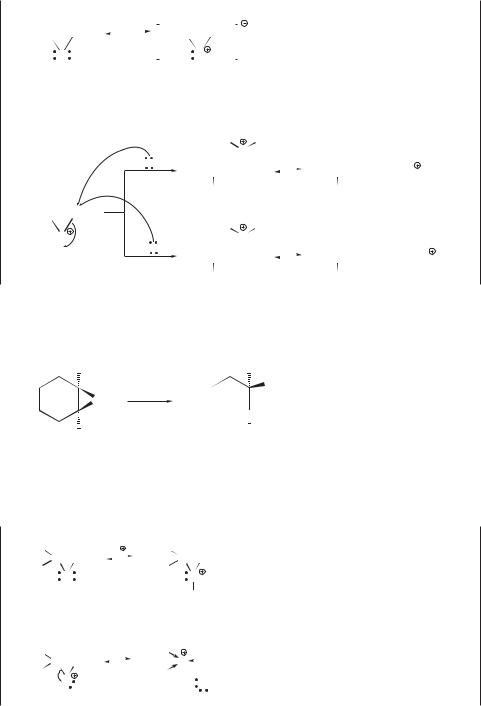
Реакции оксиранов со слабыми нуклеофилами — водой и спиртами — легко протекают в присутствии кислотных катализаторов (Н2SO4, H3PO4):
H2O
H2SO4 CH2 CH2 этиленгликоль
OH OH
CH2 CH2
O
CH3OH
CH2 CH2 метилцеллозольв
H2SO4 (метиловый эфир
OH OCH3 этиленгликоля)
Механизм раскрытия эпоксидного цикла зависит от строения оксирана. С этиленоксидом и моноалкилэтиленоксидами реакция идет по механизму SN2 и включает следующие стадии.

18.2. Циклические эфиры |
425 |
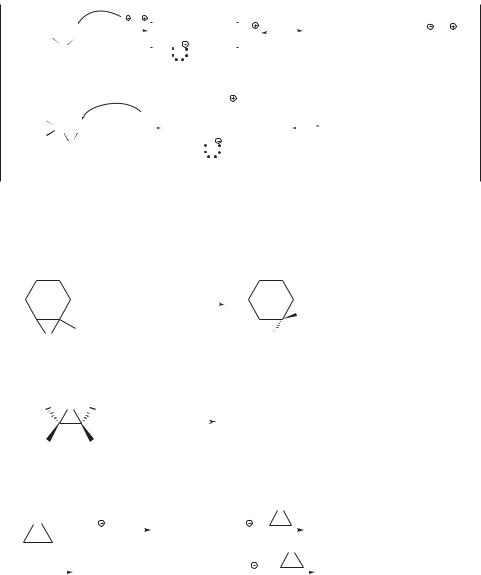
Задача 18.4. Завершите следующие реакции. Назовите продукт каждой из них по систематической номенклатуре.
a) CH3 |
|
|
б) |
CH3 |
|
|
|
+ C2H5O Na |
|
|
|
+ НCl |
|
CH3 |
(C2H5OH) |
CH3 |
||||
O |
O |
|||||
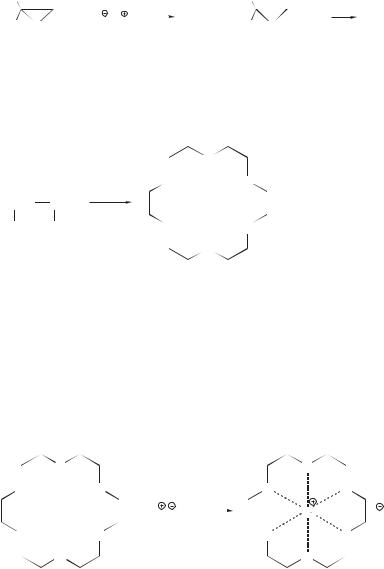
18.2.3.Краун-эфиры
Краун-эфиры получают дегидратацией этиленгликоля или реакцией α,ω-диола с α,ω-дихлоридом в присутствии основания:
O
OO
K
6CH2 CH2 –6H2O
OH OH |
O |
O |
O
[18]-краун-6
Наиболее важным свойством краун-эфиров является их способность образовывать комплексы с ионами металлов, причем различные краун-эфиры образуют комплексы с различными ионами.
Возможность комплексообразования с тем или иным ионом определяется размером цикла краун-эфира. Краун-эфир высокоизбирательно вступает в комплексообразование с ионом металла, соответствующим своими размерами размеру внутренней полости молекулы данного эфира. Например, [18]-краун-6 имеет размер внутренней полости (d ≈ 2,6–3,2 Å), пригодный для катиона калия (dиона ≈ 2,7 Å).
|
O |
|
O |
|
O |
O |
|
O |
O |
|
+ K OH |
|
K |
OH |
|
|
|||
O |
O |
|
O |
O |
|
O |
|
O |
|
Вследствие такого комплексообразования иона калия его гидроксид, а также различные соли (например, перманганат калия) приобретают растворимость в неполярных органических растворителях, в том числе и в бензоле. В чистом бензоле как гидроксид калия, так и неорганические соли калия нерастворимы.

Наиболее важные представители |
427 |
Масс-спектры. В масс-спектрах простых эфиров интенсивность пика молекулярного иона незначительна. При α-разрыве C-O-связи молекулярного иона наблюдаются малоинтенсивные пики алкильных фрагментов R1 и R2, которые расщепляются далее по типу алканов с образованием осколочных ионов m/z 29 (С2Н5 ), 43 (С3Н7 ), 57 (С4Н9 ) и т. д.
 R1 +
R1 +  OR2
OR2
R1 O R2
 R2 +
R2 +  OR1
OR1
Наиболее интенсивные пики в масс-спектрах простых эфиров образуются при β-распаде молекулярного иона, причем в виде радикала легче отщепляется наиболее объемная группа. Например, в масс-спектре этил- втор-бутилового эфира наиболее интенсивные пики m/z 73 и m/z 87 соответствуют отщеплению соответственно этильного и метильного радикалов от молекулярного иона:
CH3CH2O CH CH2CH3
|
|
m/z 102 |
CH3 |
||
CH3CH2O |
|
CHCH3 + CH2CH3 |
CH3CH2O |
|
CHCH2CH3 + CH3 |
|
|
||||
|
|
||||
m/z 73 |
m/z 87 |
||||
НАИБОЛЕЕ ВАЖНЫЕ ПРЕДСТАВИТЕЛИ
Диэтиловый эфир (этиловый эфир, серный эфир) С2Н5ОС2Н5 получают дегидратацией этанола. Бесцветная высоколетучая жидкость, т. кип. 34,5 °С, растворим в органических растворителях и воде (6,5% при 20 °С). Применяют в качестве растворителя нитратов целлюлозы и жиров, а также в качестве экстрагента ионов редких металлов.
Наркотическое средство, ПДК 300 мг/м3. Огнеопасен, т. самовоспл. 180 °С.
| | Этиленоксид СН2ОСН2 получают окислением этилена и щелочной обработкой этилен-
хлоргидрина. Бесцветный газ, т. кип. 10,7 °С. Применяют в органическом синтезе
для получения мономеров (акрилонитрил), ценных растворителей и ПАВ. Целлозольвы (моноэфиры этиленгликоля) ROCH2CH2OH получают взаимодействием
этиленоксида со спиртами. Бесцветные жидкости, растворимы в воде и органических растворителях. Применяют в качестве растворителей эфиров целлюлозы и в син-
тезе пластификаторов.
Диглим (диметиловый эфир диэтиленгликоля) СН3ОСН2СН2ОСН2СН2ОСН3 получают из метилцеллозольва и этиленоксида. Бесцветная вязкая жидкость, мало растворима в воде, растворяется в органических растворителях. Применяют в качестве раствори-
теля, экстрагента ионов редких металлов.
Тетрагидрофуран (оксолан) (СН2)4О получают гидрированием фурана при 80–140 °С. Бесцветная жидкость, т. кип. 65,6–65,8 °С, смешивается с водой и органическими растворителями. Применяется в производстве γ-бутиролактона, а также в качестве растворителя в процессах органического синтеза и для полимерных материалов (поливинилхлорида и винилхлорида). Т. самовоспл. 250 °С.
Макролиды. Транспорт ионов через клеточные мембраны |
429 |
Ниже приведены данные, полученные при расщеплении циклогексилметилового эфира [3]
C6H11 |
|
Si–I |
|
|
C6H11OSiMe3 + CH3I |
(95%) |
||
|
|
|
||||||
|
O |
+ (CH |
) |
|
|
|
|
|
|
|
|
|
|
||||
|
|
3 |
3 |
|
CDCl3, 25 °C |
|
C6H11I + CH3OSiMe3 |
|
|
|
|
||||||
CH3 |
|
|
|
|
(5%) |
|||
|
|
|
|
|||||
Поскольку иодсиланы являются весьма дорогими реагентами, предложены схемы их применения in situ, а также активирование иодом. В этом случае гладко расщепляют не только простые, но и и сложные эфиры [5–8]:
Me3SiCl, NaI
COOCH3 
 COOSiMe3 + CH3I
COOSiMe3 + CH3I
CH3CN
Комбинация трифторида бора и алкилтиола также эффективно «работает» при расщеплении простых эфиров [4].
CH |
|
O–CH |
|
BF3 |
CH |
|
OH (90%) |
|
3 |
2 |
C2H5SH |
3 |
|||||
|
|
|
|
|||||
|
|
Br |
|
|
|
|
Br |
Дополнения!
МАКРОЛИДЫ. ТРАНСПОРТ ИОНОВ ЧЕРЕЗ КЛЕТОЧНЫЕ МЕМБРАНЫ
В разд. 18.2.3 были рассмотрены комплексообразующие свойства краунэфиров. Результаты соответствующих исследований Ч. Педерсена, опубли-
кованные в 1967 г., были позднее отмечены Нобелевской премией (1987 г.). Интересно, что в этих исследованиях, как и во многих других, химики моделировали природные структуры и их функции. В живых организмах функции, аналогичные краун-эфирам, выполняют так называемые ионофоры — соединения, предназначенные в организме для переноса катионов через оболочку (мембрана) внутрь клетки.
В продолжении изучения биохимических процессов, происходящих в клетке, рассмотренных уже в нескольких главах, мы познакомимся подробнее с организацией клеток и их функциями.
Основой клеточной теории является утверждение о том, что все живые существа — животные, растения, простейшие организмы — состоят из клеток. Именно клетка является основной единицей живой материи. В клетках протекают многие жизненно важные биохимические процессы, синтезиру-
430 |
Дополнения |
ются многие белки и ферменты. Клетки высших животных очень разнообразны по форме, строению и функциям. Вследствие функциональной специализации разные категории клеток приобретают особые, характерные для них свойства. Однако имеются признаки, общие для всех клеток.
Прежде всего, это размер клеток. Диаметр типичной клетки составляет 1 мкм, а объем 5 10–16 л. Концентрация химических частиц в клетке изме-
няется от миллимолярной до микромолярной, что соответствует содержанию этих частиц от 5 10–19 до 5 10–22 моль.
Клетка состоит из протоплазмы, в которой находится ядро, и плазматической мембраны. Непременным условием нормальной работы клетки является проницаемость стенки клетки (которая образована плазматической мембраной) для химических соединений, участвующих в биосинтезе. Материалом плазматической мембраны служат липиды и белки. О белках более подробно будет изложено в гл. 27. Что касается липидов, то прежде всего удивительно большое разнообразие классов соединений, которые относят к этой группе природных веществ, — жиры, масла, стероиды, терпены; они гидрофобны и растворяются в неполярных растворителях, а поэтому легко проникают через мембрану клетки.
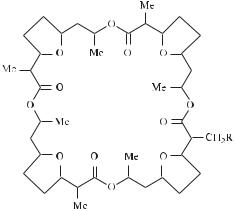
С неорганическими катионами дело обстоит сложнее. В физиологических условиях катионы окружены молекулами воды, т. е. гидратированы. Чтобы проникнуть через мембрану — липофильную структуру — внутрь клетки, ионы должны сменить оболочку с гидрофильной на гидрофобную. Для этой цели и служат ионофоры. В химическом отношении ионофоры относятся к группе макролидов — макроциклических соединений, в которых макроцикл включает несколько десятков атомов (рис. 18.1). В составе этих макроциклов имеются фрагменты простых и сложных эфиров. Попадая внутрь макролида (аналогично тому, что имеет место в случае краунэфиров), катион металла приобретает гидрофобные свойства. Нонактин обеспечивает транспорт через мембраны ионов калия, а монактин помогает и ионам калия, и ионам натрия.
Рис. 18.1. Структура нонактина (R = H) и монактина (R = CH3)

 , H
, H
 H OH
H OH δ
δ

 CH
CH

 CH
CH δ 1,5 м. д.
δ 1,5 м. д.
 R–OH + (CH
R–OH + (CH