
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
10.3. Алкенилбензолы |
111 |
Дегидрирование этилбензола
В промышленности стирол получают дегидрированием этилбензола, пропуская его пары при высокой температуре через слой твердого катализатора (ZnO, Fe2O3 или Сr2O3):
|
CH2CH3 |
ZnO |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
+ H2 |
|||
|
|
600—650 °C |
|
|
|
|
|||
этилбензол |
стирол (92%) |
||||||||
|
|
||||||||
Процесс осложняется частичной олигомеризацией стирола, поэтому его проводят в присутствии ингибиторов полимеризации.
Задача 10.4. Предложите оптимальную схему получения п-бромстирола из бензола.
10.3.2.Реакции
Реакционная способность стирола и других алкенилбензолов обусловлена прежде всего наличием двойной связи в их молекулах. Эти соединения способны ко всем реакциям алкенов.
Гидрирование алкенилбензолов протекает с высокой региоселективностью, т. е. по двойной связи алкенильной группы:
|
|
|
CH3 |
|
|
|
|
|
CH3 |
||||||||
|
|
|
|
|
|
||||||||||||
|
C |
|
CH |
|
CH3 |
+ H2 |
Pt |
CH |
|
CH2 |
|
CH3 |
|||||
|
|
||||||||||||||||
|
|
|
|
|
|||||||||||||
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
Br |
||||||||||||||
2-(м-бромфенил)-2-бутен |
|
|
2-(м-бромфенил)бутан (92%) |
||||||||||||||
Другие реакции электрофильного присоединения также протекают с высокими выходами.
CH |
|
|
CH2 + Br2 |
|
|
|
|
CH |
|
CH2Br |
|
||||||||||
|
|
(CCl4) |
|
|
|
|||||
|
|
|
||||||||
|
|
|
|
|
|
Br |
||||
стирол |
1,2-дибром-1-фенилэтан |

112 |
Глава 10. Алкил- и алкенилбензолы |
Региоселективность реакций присоединения стирола и его производных с несимметричными реагентами определяется способностью бензольного кольца стабилизировать соседний карбокатионный или радикальный центр:
|
H |
H |
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
H Cl |
|
|
|||||
|
|
|
|
|
|
HCl |
|
|
|
|
|||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
неустойчивый |
инден |
устойчивый |
|
|
1-хлориндан |
||||||||
карбокатион |
|
|
|
|
карбокатион |
|
|
(75–84%) |
|||||
В присутствии пероксидов бромоводород присоединяется к стиролу против правила Марковникова.

 CH CH2
CH CH2
Br
HBr
 CH
CH CH2
CH2  менее устойчивый радикал
менее устойчивый радикал
пероксид
стирол

 CHCH2Br
CHCH2Br
более устойчивый радикал

 CH2CH2Br
CH2CH2Br
β-бромэтилбензол (основной продукт)
Промышленное применение стирола связано прежде всего с процессами полимеризации. Полистирол является универсальным конструкционным и электроизоляционным материалом.
C6H5 C6H5 C6H5
n C6H5 CH CH2
CH2
n–2
стирол |
полистирол |
Сополимер стирола с 1,3-бутадиеном относится к группе ценных синтетических каучуков.
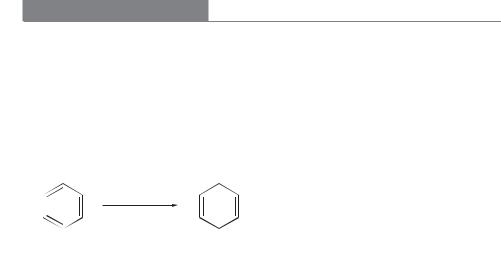
Восстановление бензола и его производных по Берчу |
113 |
НАИБОЛЕЕ ВАЖНЫЕ ПРЕДСТАВИТЕЛИ
Толуол С6Н5СН3 выделяют из летучих продуктов коксохимического производства, в процессах каталитического риформинга нефтяных фракций С6–С8. Бесцветная жидкость со своеобразным запахом, т. кип. 110,6 °С, с водой не смешивается, смешивается с этанолом, диэтиловым эфиром, углеводородами. Применяют в производстве бензола, бензойной кислоты, толуилендиизоцианатов, нитротолуолов, бензилхлори-
да и бензотрихлорида. Обладает слабым наркотическим действием. ПДК 50 мг/м3. Ксилолы С6Н4(СН3)2 получают в виде смеси изомеров (60–70% мета-, 25–35% орто-,
5% пара-) при каталитическом риформинге нефтяных фракций С6–С8. Пахучая жидкость, т. кип. 138–144 °С, очень плохо растворима в воде, легко — в этаноле, диэтиловом эфире, ацетоне, бензоле. Применяют в качестве растворителей в производстве лакокрасочных материалов и высокоактивной добавки к авиационным бензинам. В виде индивидуальных изомеров используют для получения соответствующих фталевых и толуиловых кислот, ксилидинов, фталодинитрилов. ПДК 50 мг/м3.
Кумол С6Н5СН(СН3)2 получают жидкофазным (катализатор AlCl3) или газофазным (катализатор H3PO4) алкилированием бензола пропиленом. Пахучая жидкость, т. кип. 152,4 °С, не растворяется в воде, смешивается с этанолом, диэтиловым эфиром, бензолом. Применяют в производстве фенола и ацетона, α-метилстирола, в качестве растворителя в производстве лакокрасочных материалов. ПДК 50 мг/м3.
Стирол C6H5CH=CH2 получают каталитическим дегидрированием этилбензола. Бесцветная жидкость, т. кип. 145,2 °С, очень плохо растворим в воде, смешивается с этанолом, эфиром, сероуглеродом. Применяют в качестве мономера в производствах полистирола, бутадиен-стирольного каучука, термоэластопластов, сополимеров с акрилонитрилом, винилхлоридом. Раздражает слизистые оболочки дыхательных путей и глаз. ПДК 5 мг/м3.
Для углубленного изучения!
ВОССТАНОВЛЕНИЕ БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ ПО БЕРЧУ
Восстановление бензола, алкилбензолов и их производных щелочными ме-
таллами (Na, Li или K) в смеси жидкого аммиака и спирта известно как
восстановление по Берчу (1944 г.) [1, 2].
В этой реакции конечным продуктом восстановления оказывается циклогексадиен или его производное.
Na
NH3, C2H5OH
бензол |
1,4-циклогексадиен |
Реакция протекает с промежуточным образованием анион-радикала производного бензола. Строение конечного продукта определяется сим-

114 |
Для углубленного изучения |
метрией низшей свободной молекулярной орбитали исходного субстрата, поскольку на этой МО находится неспаренный электрон в анион-радикале. Водород присоединяется к тем атомам углерода молекулы субстрата, которые имеют максимальные значения коэффициентов в НСМО.
Толуол и п-ксилол восстанавливаются до 1-метил-1,4-циклогексадиена и 1,4-диметил-1,4-циклогексадиена соответственно:
CH3 |
CH3 |
CH3 |
|
|
H |
+e |
+2H |
H |
|
|
H |
|
|
H |
CH3 |
CH3 |
CH3 |
п-ксилол |
|
1,4-диметил- |
1,4-циклогексадиен
Аналогично восстанавливают и о-ксилол.
1,2-Диметил-1,4-циклогексадиен. К раствору натрия (30 г, 1,3 моль) в жидком аммиаке (400 мл) медленно по каплям при температуре от –70 до –65 °С прибавляют смесь о-ксилола (54 г, 0,51 моль) и абсолютного метанола (51 г, 1,6 моль) и перемешивают до исчезновения синей окраски. Испаряют аммиак и полученную смесь углеводородов подвергают повторному восстановлению. Продукт выделяют перегонкой, т. кип. 38–40 °С (12 мм рт. ст.). Выход 91%.
Такое же строение имеют продукты восстановления других производных бензола, имеющих электронодонорные заместители, например метоксигруппы. Согласно симметрии НСМО таких субстратов, протонирование их анион-радикалов должно идти по положениям 2 и 5:
OCH3 |
OCH3 |
1. Na, NH3/C2H5OH
2. NH4Cl
анизол |
1-метокси- |
|
1,4-циклогексадиен |

Гидрогенолиз бензильных производных. Бензильная защита… |
115 |
Производные бензола, содержащие электроноакцепторные заместители, имеют иную симметрию НСМО. Их анион-радикалы присоединяют протоны по положениям 1 и 4, имеющим максимальные значения коэффициентов в НСМО:
COOH |
COOH |
H COOH |
|
|
|
+e |
|
+2H |
|
|
H H |
бензойная |
|
2,5-циклогексадиен- |
кислота |
|
1-карбоновая кислота |
Также протекает восстановление по Берчу и молекулы 1,4-бис(триме- тилсилил)бензола:
Si(CH3)3 |
|
|
H |
Si(CH ) |
|||
|
|
|
|
|
|
3 3 |
|
|
|
1. Na, NH3/C2H5OH |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
2. NH4Cl |
|
|
|
|
|
|
|
|
H |
Si(CH3)3 |
|||
Si(CH ) |
|
|
|||||
3 3 |
|
|
|
|
|
||
1,4-бис(триметилсилил)- |
3,6-бис(триметилсилил)- |
||||||
бензол |
|
1,4-циклогексадиен |
|||||
Кремний является аналогом углерода по IV группе Периодической системы. Однако, в отличие от последнего, атом кремния обладает вакантными 3d-орбиталями. По этой причине триметилсилильная группа способна выступать в качестве электроноакцептора по отношению к π-системе бензольного кольца. Этим и объясняется результат реакции, отличный от превращений алкилбензолов в аналогичных условиях.
ГИДРОГЕНОЛИЗ БЕНЗИЛЬНЫХ ПРОИЗВОДНЫХ. БЕНЗИЛЬНАЯ ЗАЩИТА ФУНКЦИОНАЛЬНЫХ ГРУПП
К особенностям соединений, содержащих бензильную группу, относится их легкий гидрогенолиз [3а, б]. В общем виде эта реакция заключается в следующем:
CH2X |
|
CH3 |
||
|
|
[H] |
|
+ HX |
|
|
|
||
|
|
|
|
|
бензильное |
толуол |
производное |
|

116 |
Для углубленного изучения |
В качестве заместителя Х выступают атомы галогена, гидроксиили сложноэфирные группы. Гидрогенолиз протекает легко как при действии литийалюминийгидрида, так и при гидрировании над палладием:
|
CH2Br |
|
|
CH3 |
|||||||
|
|
|
|
LiAlH4 |
|
|
|
|
|||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
бензилбромид |
|
|
толуол |
||||||||
OH |
|
|
H |
||||||||
R |
R' |
|
|
R |
R' |
||||||
C |
|
|
C |
||||||||
|
|
|
|
H2, Pd/C |
|
|
|||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
α-гидрокси- |
|
|
алкилбензол |
||||||||
алкилбензол |
|
|
|
|
|
|
|
|
|||
Это свойство бензильных производных послужило причиной широкого применения бензильного фрагмента в качестве хорошо удаляемой защитной группы в многостадийных схемах. Часто в таких схемах требуется защита реакционноспособной функциональной группы, проведение соответствующих превращений, а затем легкое и количественно протекающее снятие защитной группы. Для снятия бензильной защиты наиболее пригодна реакция гидрогенолиза:
|
|
O |
|
|
|
O |
|
|
|
|
H2, Pd/C |
+ C6H5CH3 |
|||
R |
|
C |
|
R |
|
C |
|
|
|
|
|||||
|
|
OCH2C6H5 |
|
|
|
OH |
|
бензил карбоксилат |
|
карбоновая |
толуол |
||||
|
|
|
|
кислота |
|
||
Бензильная защита успешно применяется, в частности, в синтезе пептидов (т. III, гл. 27). О защитных группах в органических реакциях см. также в разд. 16.7.4.

Лекарства — производные бензола. Антагонисты и агонисты |
117 |
Дополнения!
ЛЕКАРСТВА — ПРОИЗВОДНЫЕ БЕНЗОЛА. АНТАГОНИСТЫ И АГОНИСТЫ
В живых организмах встречаются многочисленные соединения, содержащие бензольный фрагмент. Среди них в первую очередь следует назвать α-аминокислоты, в молекулах которых имеется бензольное кольцо.
CH2 CH COO |
HO |
CH2 CH COO |
NH3 |
|
NH3 |
фенилаланин |
|
тирозин |
Поскольку человеческий организм не обладает способностью биохимически синтезировать бензольное кольцо, и фенилаланин, и тирозин относятся к числу так называемых незаменимых аминокислот. Такие аминокислоты поступают в наш организм только с пищей.
В качестве еще одного характерного примера органического соединения, содержащего бензольный фрагмент, можно вспомнить ранее упомянутый женский стероидный половой гормон эстрадиол.
H3C OH
H
HH
HO
эстрадиол
Уже эти примеры показывают, что производные бензола могут быть совместимы с биологическими субстратами. Еще более в этом убеждают рассмотренные ниже примеры лекарственных препаратов.
Как было показано ранее в этой главе, на основе реакций SEAr и последующих превращений в молекулу бензола могут быть введены разнообразные функциональные группы. Оказывается, что каждая такая группа определенным образом трансформирует не только химическое поведение арена. Некоторые из функциональных групп сообщают соот-
ветствующей молекуле и фармакологические свойства. Такие группы называют фармакофорами. К ним, безусловно, следует отнести карба-

118 |
Дополнения |
мидные, сложноэфирные и эфирные группы. Это видно на примере фенацетина и парацетамола, которые относятся к группе ненаркотических анальгетиков (болеутоляющие средства).
C2H5O |
|
|
NHCOCH3 |
HO |
|
NHCOCH3 |
|
фенацетин |
|
парацетамол |
|||
Интересно, что парацетамол является метаболитом фенацетина и, как
установлено, является лекарством при применении и того, и другого средства. Фенацетин поэтому следует рассматривать как пролекарство. Параце-
тамол часто применяют в качестве жаропонижающего средства. Особенно эффективной оказывается комбинация парацетамола с аспирином (ацетилсалициловая кислота). В этом случае усиливается и жаропонижающий, и болеутоляющий эффект. Кроме того (и это очень важно), парацетамол защищает слизистую оболочку желудка от раздражающего действия ацетилсалициловой кислоты.
COOH
OCOCH3
аспирин
Как работают лекарства? В чем состоят функции фармакофорных групп?
Одно из главных свойств молекулы соединения, обладающего фармакологическим эффектом, заключается в его способности эффективно взаимодействовать с соответствующим рецептором — активным фрагментом протоплазмы клетки. Такое взаимодействие оказывается возможным лишь в
том случае, если молекула лекарства и рецептор имеют в своих структурах совместимые фрагменты — так называемые комплементарные участки. Об-
разно говоря, такие участки должны подходить друг к другу как ключ к замку. При этом взаимодействие лекарство–рецептор, как правило, не обусловлено образованием прочных ковалентных связей. Более значимыми в таком взаимодействии оказываются водородные и координационные связи, ван-дер-ваальсовы и электростатические силы.
В некоторых случаях фиксация молекулы лекарства на рецепторе, блокирующая его активную поверхность, сама по себе уже оказывается причи-

Лекарства — производные бензола. Антагонисты и агонисты |
119 |
ной фармакологического эффекта. Так работают лекарства, действующие по принципу антагонистов.
NH2 |
NH2 |
H2N S O |
C |
O |
HO O |
|
|
белый |
п-аминобензойная |
стрептоцид |
кислота (ПАБ) |
Одним из наиболее характерных примеров успешной работы лекарства по типу антагониста является фармакологический эффект белого стрептоцида (п-аминобензолсульфамид): молекула п-аминобензолсульфамида блокирует на рецепторе место связывания п-аминобензойной кислоты (ПАБ), выводит эту кислоту из биохимического цикла синтеза дигидрофолиевой кислоты, жизненно необходимой для нормального развития бактерий, и оказывает тем самым выраженный антибактериальный эффект.
|
|
|
|
|
|
|
H |
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
HOOC |
|
NCН2 |
N |
|
|
|
NH |
|||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||
NH |
|
|
|
|
|
|
|
|
||||||
|
N N NH2 |
|||||||||||||
HOOC |
|
|
|
|
|
|||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
H |
||||||
O |
||||||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
дигидрофолиевая |
||||||
|
|
|
|
|
|
|
|
кислота |
||||||
фрагмент ПАБ
Многие лекарства работают по типу агониста. Такие соединения, помимо способности связываться с рецептором, обладают еще и соответствующим физиологическим эффектом («внутренняя активность»). Одной из разновидностей такой активности могут быть, например, конформационные изменения в белковой части рецептора, сопровождаемые изменениями в проходимости ионных каналов, а следовательно, и в доступе или прекращении доступа соответствующих ионов. Баланс ионов в клетке, в свою очередь, имеет важнейшее значение для ее нормального функционирования. Ионы Na , K , Ca2 , в частности, участвуют в передаче нервных сигналов.

120 |
Дополнения |
По типу агонистов работает, например, ряд гидроксипроизводных бензола, являющихся нейромедиаторами.
HO H
HO 
 NH2
NH2
HO
норадреналин
Нейромедиаторами называют небольшие молекулы, которые под действием электрического сигнала высвобождаются из одной нервной клетки и достигают рецептора на другой нервной клетке. Раздражая или блокируя его, они влияют, таким образом, на передачу нервного сигнала.
В частности, норадреналин выполняет функции нейромедиатора во многих структурах, где находятся нервные окончания; его спектр действия широк. Некоторые из рецепторов, где работает норадреналин, связаны с дыхательными путями; другие — с сердечно-сосудистой системой. Эта универсальность норадреналина является, кстати, и его серьезным недостатком. Принимая, например, это лекарство как средство для облегчения состояния при обострении бронхиальной астмы, пациент рискует вызвать сердечный приступ.
Произведя модификацию молекулы норадреналина, химики получили лекарства, обладающие более высокой избирательностью. Например, изопреналин облегчает течение астмы и имеет менее выраженные побочные эффекты.
|
HO H |
HO H |
||
HO |
|
NHCH(CH3)2 |
HO |
NHC(CH3)3 |
|
|
|
|
|
|
|
|
|
|
HO |
|
|
HO |
|
|
|
изопреналин |
сальбутамол |
|
Сальбутамол является еще более избирательным средством против астмы.
