
- •Функции состояния и функции процесса. Понятие теплоты и работы. Понятия равновесного и неравновесного процесса.
- •Первый закон термодинамики. Принцип эквивалентности теплоты и работы. Опыт Джоуля.
- •Формулировки и аналитические выражения I закона термодинамики. Энергия и работа, их виды.
- •Формулировки и аналитические выражения I закона термодинамики. Понятия внутренней энергии и энтальпии, их свойства.
- •Уравнение I закона термодинамики для неравновесных процессов.
- •Уравнение I закона термодинамики для потока вещества (вывод, основные допущения, понятие входящих в уравнение величин).
- •Понятие идеального газа. Уравнение состояния идеального газа. Газовые постоянные. Термические коэффициенты идеального газа.
- •Понятие теплоемкости. Виды теплоемкости. Изохорная и изобарная теплоемкость, их связь.
- •Расчет адиабатного процесса с учетом зависимости теплоемкости от температуры. Функции и .
- •Политропный процесс. Соотношение между термическими параметрами в политропном процессе. Расчет работы расширения и теплоты в политропном процессе.
- •Основные характеристики смеси идеальных газов. Свойства смеси. Закон Дальтона. Закон Амага.
- •Понятие об обратимых и необратимых процессах. Примеры необратимых процессов. Причины необратимых процессов. Формулировки II закона термодинамики.
- •Круговые процессы или циклы. Прямой обратимый цикл Карно. Обратный обратимый цикл Карно. Характеристики эффективности циклов.
- •Цикл Карно. Кпд цикла Карно. Теорема Карно.
- •Понятие энтропии. Интеграл Клаузиуса. Свойства энтропии.
- •Вывод формулы для расчета изменения энтропии смеси газов.
- •-Диаграмма. Взаимное расположение изобары и изохоры в -диаграмме. Взаимное расположение в -диаграмме изобар различных давлений и изохор различных объемов.
- •Понятие среднеинтегральной температуры подвода (отвода) теплоты. Следствие теоремы Карно (вторая теорема Карно).
- •Изменение энтропии в необратимых процессах. Понятие энтропии изолированной системы.
- •Статистический характер II закона термодинамики. Термодинамическая вероятность. Взаимосвязь энтропии и термодинамической вероятности. Ограниченный характер II закона термодинамики.
- •Понятие эксергии. Эксергия неподвижной системы (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия потока вещества (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия источника теплоты с постоянной и переменной температурой. Эксергетическая функция.
- •Потери эксергии в необратимых процессах. Формула Гюи-Стодола. Эксергетический коэффициент полезного действия. Примеры вычисления эксергетического кпд.
- •Характеристические функции (определение, соответствующие им независимые переменные). Частные производные характеристических функций разных порядков.
- •Отличия свойств реальных газов от идеальных. Тройная точка, критическая точка. Фазовая -диаграмма для нормальных и аномальных веществ.
- •Условия фазового равновесия (вывод). Правило фаз Гиббса (примеры применения).
- •Вывод и физический смысл уравнения Клапейрона-Клаузиуса.
- •Основные термодинамические процессы с реальными газами: изотермический, изобарный, изохорный процесс. Определение теплоты и работы в процессах. Построение процессов в диаграммах .
- •Обратимый и необратимый адиабатный процесс реального газа. Расчет работы расширения и технической работы.
- •Адиабатное дросселирование. Представление процесса дросселирования водяного пара в -диаграмме. Коэффициент Джоуля-Томпсона.
- •Дифференциальное и интегральное уравнения адиабатного дроссель-эффекта. Кривая инверсии, ее уравнение и представление в -диаграммах.
- •Зависимость изобарной теплоемкости реального газа в однофазной области от температуры и давления.
- •Уравнение Ван-дер-Ваальса. Физический смысл поправок в его составе. Возможные решения уравнения. Устойчивые и неустойчивые состояния вещества.
- •Вириальное уравнение состояния. Вириальные коэффициенты, способы их определения.
- •Тепловая теорема Нернста. Третий закон термодинамики.
- •Следствия III закона термодинамики.
-
Вывод формулы для расчета изменения энтропии смеси газов.
 ,
,
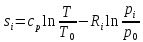 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
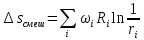 ,
– энтропия смешения.
,
– энтропия смешения.
-
-Диаграмма. Взаимное расположение изобары и изохоры в -диаграмме. Взаимное расположение в -диаграмме изобар различных давлений и изохор различных объемов.
В -диаграмме
наглядно изображаются количества
теплоты, подводимой и отводимой к газу,
работа полученная в процессе, теплоемкость
газа.
-диаграмме
наглядно изображаются количества
теплоты, подводимой и отводимой к газу,
работа полученная в процессе, теплоемкость
газа.

 .
.
Взаимное расположение изобары и изохоры в -диаграмме
 ,
,
 ,
следовательно, изохора в
,
следовательно, изохора в
 -диаграмме
изображается более крутой линией, чем
изобара.
-диаграмме
изображается более крутой линией, чем
изобара.
Взаимное расположение -диаграмме изобар различных давлений и изохор различных объемов
 ,
,

изобары на диаграмме не эквидистантны, причем изобары более высокого давления смещаются в сторону меньших значений энтропии;
 ,
,
изохоры на диаграмме не эквидистантны, причем изохоры более высокого объема смещаются в сторону больших значений энтропии.
-
Понятие среднеинтегральной температуры подвода (отвода) теплоты. Следствие теоремы Карно (вторая теорема Карно).
Среднеинтегральная температура подвода (отвода) теплоты
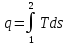 ,
,
 ,
,
 ,
,
 ,
,
 – температура
подвода,
– температура
подвода,
 – температура отвода,.
– температура отвода,.
Следствие
из теоремы Карно (вторая теорема Карно):
термический КПД любого обратимого
цикла, осуществляемого при числе
источников теплоты больше двух, меньше
термического КПД обратимого цикла
Карно, осуществляемого в том же интервале
температур.
Сравним произвольный цикл I с циклом Карно II, протекающем в том же температурном интервале.
Опишем вокруг цикла I цикл Карно 1-2-3-4 – цикл III,
 ,
,
 ,
,
 .
.
-
Изменение энтропии в необратимых процессах. Понятие энтропии изолированной системы.
Изменение
энтропии в необратимых процессах
Рассмотрим
систему, в которой существует необратимый
теплообмен при
 источника и
источника и
 рабочего тела,
рабочего тела,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
– для необратимых процессов.
,
– для необратимых процессов.
 ,
– аналитическое выражение II
закона термодинамики для всех процессов.
,
– аналитическое выражение II
закона термодинамики для всех процессов.
Энтропия изолированной системы
 ,
,
при прохождении самопроизвольных процессов достигается состояние равновесия, в котором энтропия максимальна
 .
.
Изменение энтропии изолированной системы является критерием:
-
направления процессов в системе;
-
обратимости или необратимости процессов в системе;
-
равновесного состояния системы;
-
обесцененности внутренней энергии системы, так как при прохождении необратимых процессов, энергия изолированной системы постоянна, а энтропия возрастает, что ведет к уменьшению работоспособности системы.
-
Статистический характер II закона термодинамики. Термодинамическая вероятность. Взаимосвязь энтропии и термодинамической вероятности. Ограниченный характер II закона термодинамики.
Статистический характер II закона термодинамики
Термодинамическая вероятность – число микросостояний, реализующих данное макросостояние системы.
 ,
,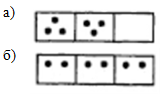
 ,
,
термодинамическая вероятность равномерного распределения всегда больше любого другого; это определяет направление развития процессов в системе.
Взаимосвязь энтропии и термодинамической вероятности
 ,
,
рассмотрим две системы
 ,
,
 ,
,
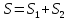 ,
,
 ,
,
 ,
,
дифференцируем
по
 :
:
 ,
,
дифференцируем
по
 :
:
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
определим
константу
 :
:
 ,
,
 ;
;
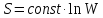 ,
,
 – константа Больцмана,
– константа Больцмана,
формула Больцмана:
 .
.
Ограниченный характер II закона термодинамики
II закон термодинамики неприменим к системам малого молекулярного раствора и к бесконечно большим (планетарного масштаба) системам, но для систем реальных растворов II закон термодинамики можно считать абсолютным.
