
- •Функции состояния и функции процесса. Понятие теплоты и работы. Понятия равновесного и неравновесного процесса.
- •Первый закон термодинамики. Принцип эквивалентности теплоты и работы. Опыт Джоуля.
- •Формулировки и аналитические выражения I закона термодинамики. Энергия и работа, их виды.
- •Формулировки и аналитические выражения I закона термодинамики. Понятия внутренней энергии и энтальпии, их свойства.
- •Уравнение I закона термодинамики для неравновесных процессов.
- •Уравнение I закона термодинамики для потока вещества (вывод, основные допущения, понятие входящих в уравнение величин).
- •Понятие идеального газа. Уравнение состояния идеального газа. Газовые постоянные. Термические коэффициенты идеального газа.
- •Понятие теплоемкости. Виды теплоемкости. Изохорная и изобарная теплоемкость, их связь.
- •Расчет адиабатного процесса с учетом зависимости теплоемкости от температуры. Функции и .
- •Политропный процесс. Соотношение между термическими параметрами в политропном процессе. Расчет работы расширения и теплоты в политропном процессе.
- •Основные характеристики смеси идеальных газов. Свойства смеси. Закон Дальтона. Закон Амага.
- •Понятие об обратимых и необратимых процессах. Примеры необратимых процессов. Причины необратимых процессов. Формулировки II закона термодинамики.
- •Круговые процессы или циклы. Прямой обратимый цикл Карно. Обратный обратимый цикл Карно. Характеристики эффективности циклов.
- •Цикл Карно. Кпд цикла Карно. Теорема Карно.
- •Понятие энтропии. Интеграл Клаузиуса. Свойства энтропии.
- •Вывод формулы для расчета изменения энтропии смеси газов.
- •-Диаграмма. Взаимное расположение изобары и изохоры в -диаграмме. Взаимное расположение в -диаграмме изобар различных давлений и изохор различных объемов.
- •Понятие среднеинтегральной температуры подвода (отвода) теплоты. Следствие теоремы Карно (вторая теорема Карно).
- •Изменение энтропии в необратимых процессах. Понятие энтропии изолированной системы.
- •Статистический характер II закона термодинамики. Термодинамическая вероятность. Взаимосвязь энтропии и термодинамической вероятности. Ограниченный характер II закона термодинамики.
- •Понятие эксергии. Эксергия неподвижной системы (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия потока вещества (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия источника теплоты с постоянной и переменной температурой. Эксергетическая функция.
- •Потери эксергии в необратимых процессах. Формула Гюи-Стодола. Эксергетический коэффициент полезного действия. Примеры вычисления эксергетического кпд.
- •Характеристические функции (определение, соответствующие им независимые переменные). Частные производные характеристических функций разных порядков.
- •Отличия свойств реальных газов от идеальных. Тройная точка, критическая точка. Фазовая -диаграмма для нормальных и аномальных веществ.
- •Условия фазового равновесия (вывод). Правило фаз Гиббса (примеры применения).
- •Вывод и физический смысл уравнения Клапейрона-Клаузиуса.
- •Основные термодинамические процессы с реальными газами: изотермический, изобарный, изохорный процесс. Определение теплоты и работы в процессах. Построение процессов в диаграммах .
- •Обратимый и необратимый адиабатный процесс реального газа. Расчет работы расширения и технической работы.
- •Адиабатное дросселирование. Представление процесса дросселирования водяного пара в -диаграмме. Коэффициент Джоуля-Томпсона.
- •Дифференциальное и интегральное уравнения адиабатного дроссель-эффекта. Кривая инверсии, ее уравнение и представление в -диаграммах.
- •Зависимость изобарной теплоемкости реального газа в однофазной области от температуры и давления.
- •Уравнение Ван-дер-Ваальса. Физический смысл поправок в его составе. Возможные решения уравнения. Устойчивые и неустойчивые состояния вещества.
- •Вириальное уравнение состояния. Вириальные коэффициенты, способы их определения.
- •Тепловая теорема Нернста. Третий закон термодинамики.
- •Следствия III закона термодинамики.
-
Понятие теплоемкости. Виды теплоемкости. Изохорная и изобарная теплоемкость, их связь.
Теплоемкость тела – количество теплоты, необходимой для нагрева тела на один градус (средняя теплоемкость).
Истинная теплоемкость – производная от количества теплоты, подводимой к телу в процессе его нагрева, по температуре этого тела:
 .
.
Виды теплоемкости:
-
Массовой теплоемкостью (c) называют количество теплоты, необходимой для изменения температуры единицы массы вещества на
 ;
; -
Мольной теплоемкостью (μc) называют теплоемкость, отнесенную к одному молю вещества;
-
Объемной теплоемкостью (C) называют теплоемкость, отнесенную к единице объема вещества.
Связь между видами теплоемкостей:
 ,
,
 – плотность вещества,
– плотность вещества,
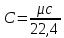 ,
,
 .
.
В зависимости от вида процесса различают:
-
Изохорную теплоемкость
 ,
,
 ,
,
 ;
;
-
Изобарную теплоемкость
 ,
,
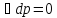 ,
,
 .
.
Связь между изохорной и изобарной теплоемкостями
Для идеального газа:
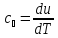 ,
,
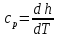 ,
,
 ,
,
 ,
,
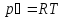 .
.
Формула Майера:
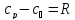 ,
,
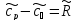 .
.
-
Молекулярно-кинетическая теория теплоемкости идеальных газов (применение для одноатомного и многоатомного газа).
Одноатомный газ
Молекулы одноатомного газа имеют лишь поступательное движение (3 степени свободы):
 ,
,
 – постоянная
Больцмана,
– постоянная
Больцмана,
 ,
,
 ,
,
 ,
,
 .
.
Многоатомный газ
 .
.
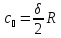 ,
,
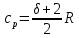 ,
,
Одноатомный:
 .
.
Двухатомный:
 ,
,
 ,
,
 .
.
Трехатомный:
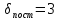 ,
,
 ,
,
 .
.
-
Порядок расчета процесса идеального газа. Расчет теплоты и работы в изобарном, изохорном и изотермическом процессах идеального газа.
Расчет процесса идеального газа:
-
уравнение процесса;
-
соотношения термических параметров;
-
 -диаграмма
процесса;
-диаграмма
процесса; -
изменение внутренней энергии;
-
изменение энтальпии;
-
работа расширения процесса;
-
расчет подводимой/отводимой теплоты.

Изохорный процесс
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
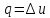 ,
,
 .
.
Изобарный
процесс
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
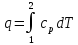 ,
,
 .
.

Изотермический процесс
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 .
.
-
Порядок расчета процесса идеального газа. Адиабатный процесс. Показатель адиабаты, уравнение адиабаты. Построение линии адиабатного процесса в
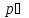 -диаграмме.
Расчет работы расширения, совершенной
газом в адиабатном процессе.
-диаграмме.
Расчет работы расширения, совершенной
газом в адиабатном процессе.
Расчет процесса идеального газа:
-
уравнение процесса;
-
соотношения термических параметров;
-
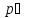 -диаграмма
процесса;
-диаграмма
процесса; -
изменение внутренней энергии;
-
изменение энтальпии;
-
работа расширения процесса;
-
расчет подводимой/отводимой теплоты.
Адиабатный процесс
 ,
– без теплообмена с окружающей средой,
,
– без теплообмена с окружающей средой,
 ,
,
 ,
,
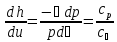 ,
,
 ,
– показатель
адиабаты,
,
– показатель
адиабаты,
 ,
,
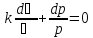 ,
,
 ,
,
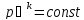 ,
– уравнение
адиабаты (Пуассона).
,
– уравнение
адиабаты (Пуассона).
Расчет работы расширения
 ,
,
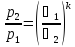 ,
,
 ,
,
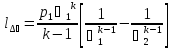 ,
,
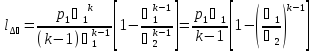 ,
,
 ,
,
 ,
,
 .
.
-
Расчет адиабатного процесса с учетом зависимости теплоемкости от температуры. Функции и .
Условие,
что
 является достаточно грубым. В
действительности у разреженных газов
является достаточно грубым. В
действительности у разреженных газов
 и
и
 возрастают с ростом температуры и
показатель адиабаты уменьшается.
возрастают с ростом температуры и
показатель адиабаты уменьшается.
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 .
.
Введем функцию:
 ,
,
тогда для процесса 1-2:
 .
.
 ,
,
 ,
,
 ,
,
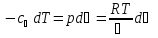 ,
,
 ,
,
 .
.
Введем функцию:
 ,
,
тогда для процесса 1-2:
 .
.
Значения
функций
 и
и
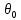 приведены в справочнике, где они
рассчитаны с учетом зависимости
теплоемкостей от температуры. Используя
их, по вычисленным значениям
приведены в справочнике, где они
рассчитаны с учетом зависимости
теплоемкостей от температуры. Используя
их, по вычисленным значениям
 и
и
 можно определить температуру газа
можно определить температуру газа
 .
Этот метод позволяет произвести точный
расчет адиабатного процесса.
.
Этот метод позволяет произвести точный
расчет адиабатного процесса.
