
- •Функции состояния и функции процесса. Понятие теплоты и работы. Понятия равновесного и неравновесного процесса.
- •Первый закон термодинамики. Принцип эквивалентности теплоты и работы. Опыт Джоуля.
- •Формулировки и аналитические выражения I закона термодинамики. Энергия и работа, их виды.
- •Формулировки и аналитические выражения I закона термодинамики. Понятия внутренней энергии и энтальпии, их свойства.
- •Уравнение I закона термодинамики для неравновесных процессов.
- •Уравнение I закона термодинамики для потока вещества (вывод, основные допущения, понятие входящих в уравнение величин).
- •Понятие идеального газа. Уравнение состояния идеального газа. Газовые постоянные. Термические коэффициенты идеального газа.
- •Понятие теплоемкости. Виды теплоемкости. Изохорная и изобарная теплоемкость, их связь.
- •Расчет адиабатного процесса с учетом зависимости теплоемкости от температуры. Функции и .
- •Политропный процесс. Соотношение между термическими параметрами в политропном процессе. Расчет работы расширения и теплоты в политропном процессе.
- •Основные характеристики смеси идеальных газов. Свойства смеси. Закон Дальтона. Закон Амага.
- •Понятие об обратимых и необратимых процессах. Примеры необратимых процессов. Причины необратимых процессов. Формулировки II закона термодинамики.
- •Круговые процессы или циклы. Прямой обратимый цикл Карно. Обратный обратимый цикл Карно. Характеристики эффективности циклов.
- •Цикл Карно. Кпд цикла Карно. Теорема Карно.
- •Понятие энтропии. Интеграл Клаузиуса. Свойства энтропии.
- •Вывод формулы для расчета изменения энтропии смеси газов.
- •-Диаграмма. Взаимное расположение изобары и изохоры в -диаграмме. Взаимное расположение в -диаграмме изобар различных давлений и изохор различных объемов.
- •Понятие среднеинтегральной температуры подвода (отвода) теплоты. Следствие теоремы Карно (вторая теорема Карно).
- •Изменение энтропии в необратимых процессах. Понятие энтропии изолированной системы.
- •Статистический характер II закона термодинамики. Термодинамическая вероятность. Взаимосвязь энтропии и термодинамической вероятности. Ограниченный характер II закона термодинамики.
- •Понятие эксергии. Эксергия неподвижной системы (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия потока вещества (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия источника теплоты с постоянной и переменной температурой. Эксергетическая функция.
- •Потери эксергии в необратимых процессах. Формула Гюи-Стодола. Эксергетический коэффициент полезного действия. Примеры вычисления эксергетического кпд.
- •Характеристические функции (определение, соответствующие им независимые переменные). Частные производные характеристических функций разных порядков.
- •Отличия свойств реальных газов от идеальных. Тройная точка, критическая точка. Фазовая -диаграмма для нормальных и аномальных веществ.
- •Условия фазового равновесия (вывод). Правило фаз Гиббса (примеры применения).
- •Вывод и физический смысл уравнения Клапейрона-Клаузиуса.
- •Основные термодинамические процессы с реальными газами: изотермический, изобарный, изохорный процесс. Определение теплоты и работы в процессах. Построение процессов в диаграммах .
- •Обратимый и необратимый адиабатный процесс реального газа. Расчет работы расширения и технической работы.
- •Адиабатное дросселирование. Представление процесса дросселирования водяного пара в -диаграмме. Коэффициент Джоуля-Томпсона.
- •Дифференциальное и интегральное уравнения адиабатного дроссель-эффекта. Кривая инверсии, ее уравнение и представление в -диаграммах.
- •Зависимость изобарной теплоемкости реального газа в однофазной области от температуры и давления.
- •Уравнение Ван-дер-Ваальса. Физический смысл поправок в его составе. Возможные решения уравнения. Устойчивые и неустойчивые состояния вещества.
- •Вириальное уравнение состояния. Вириальные коэффициенты, способы их определения.
- •Тепловая теорема Нернста. Третий закон термодинамики.
- •Следствия III закона термодинамики.
-
Уравнение Ван-дер-Ваальса. Физический смысл поправок в его составе. Возможные решения уравнения. Устойчивые и неустойчивые состояния вещества.
Уравнение Ван-дер-Ваальса – уравнение состояния реального газа
 ,
,
 – число, которое
входит в поправку, учитывает внутреннее
давление газа, то есть учитывает
взаимодействие молекул,
– число, которое
входит в поправку, учитывает внутреннее
давление газа, то есть учитывает
взаимодействие молекул,
 – поправка, учитывающая
собственный объем молекул.
– поправка, учитывающая
собственный объем молекул.
Возможные решения:
1) 3 равных действительных
корня –
 ,
,
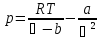 ,
,
 ,
,
 ,
,
находим
 ,
,
 ,
,
 или
или
 ,
,
 .
.
2)
3 различных действительных корня –
 ;
;
фазовый переход (докритическое давление),
 ,
,
 – давление насыщения,
– давление насыщения,
 – перегретая
жидкость,
– перегретая
жидкость,
 – переохлажденный
пар,
– переохлажденный
пар,
 – физически
нереализуемое состояние.
– физически
нереализуемое состояние.
Существование
участка
 рассматривается как доказательство
необходимости распада вещества на 2
фазы – жидкость и газ.
рассматривается как доказательство
необходимости распада вещества на 2
фазы – жидкость и газ.
Состояния
 и
и
 – метастабильные
(устойчивые).
– метастабильные
(устойчивые).
Точки
 – неустойчивое
состояние.
При их достижении вещество должно
распадаться на 2 фазы.
– неустойчивое
состояние.
При их достижении вещество должно
распадаться на 2 фазы.
3)
1 действительный и 2 мнимых корня –
 ;
;
сверхкритическое давление, при заданных давлении, температуре, возможно значение объема, мнимые корни не имеют физического смысла.
-
Вириальное уравнение состояния. Вириальные коэффициенты, способы их определения.
Теоретическое
(вириальное) уравнение состояния
реального газа
– разложение коэффициента сжимаемости
в бесконечный ряд по степеням плотности,
коэффициенты которого есть функции
температуры.
 ,
,
 ,
,
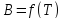 ,
,
 ,
,
 ,
… – вириальные
коэффициенты,
,
… – вириальные
коэффициенты,
 ,
,
 – расстояние между
молекулами.
– расстояние между
молекулами.
Вириальные
коэффициенты
 могут быть вычислены, если известна
зависимость потенциальной внутренней
энергии от расстояния между молекулами.
могут быть вычислены, если известна
зависимость потенциальной внутренней
энергии от расстояния между молекулами.
Потенциал Ленорда-Джонса:
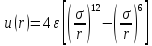 .
.
Параметры
потенциала
 для каждого газа определяются из данных
экспериментальных измерений.
для каждого газа определяются из данных
экспериментальных измерений.
Определение вириальных коэффициентов по экспериментальным данным
Задача:
имеется массив экспериментальных
значений удельного объема
 и коэффициента сжимаемости
и коэффициента сжимаемости
 на изотерме (
на изотерме ( )
при различных давлениях
)
при различных давлениях
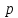 .
.
Решение:
 -диаграмма,
-диаграмма,

 ,
,
 ,
,
 ,
,
 -диаграмма,
-диаграмма,
 ,
,
 ,
,
 .
.
-
Тепловая теорема Нернста. Третий закон термодинамики.
Для определения направления и условий протекания химических реакций необходимо рассчитывать энергию Гиббса реагирующих веществ.
На
основе экспериментальных измерений
установлен ход изменения теплового
эффекта реакции
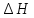 и разности энергии Гиббса
и разности энергии Гиббса
 при снижении температуры.
при снижении температуры.
Для химической реакции
 ,
,
кривые
 ,
,
 сходятся при
сходятся при
 и имеют общую касательную вблизи
абсолютно нуля
и имеют общую касательную вблизи
абсолютно нуля
 .
.
Опыты показали, что свойства твердых веществ вблизи абсолютного нуля перестают зависеть от температуры, то есть эта касательная параллельна оси абсцисс – тепловая теорема Нернста.
III
законом термодинамики.
 ,
,
 ,
,
 ,
,
то
есть при
 энтропия исходных и конечных веществ
реакций одинакова
энтропия исходных и конечных веществ
реакций одинакова
 .
.
Планк
установил, что для всех веществ при
 :
:
 ,
,
 ,
,
 (вероятность 100%).
(вероятность 100%).
Постоянство
 при 0 К означает, что изотермический
процесс вблизи абсолютного нуля является
в то же время адиабатным.
при 0 К означает, что изотермический
процесс вблизи абсолютного нуля является
в то же время адиабатным.
III закон термодинамики формулируется как принцип недостижимости абсолютного нуля, то есть невозможно создание вечного двигателя III рода – машины, с помощью которой тело может быть охлаждено до температуры абсолютного нуля.
