
- •Функции состояния и функции процесса. Понятие теплоты и работы. Понятия равновесного и неравновесного процесса.
- •Первый закон термодинамики. Принцип эквивалентности теплоты и работы. Опыт Джоуля.
- •Формулировки и аналитические выражения I закона термодинамики. Энергия и работа, их виды.
- •Формулировки и аналитические выражения I закона термодинамики. Понятия внутренней энергии и энтальпии, их свойства.
- •Уравнение I закона термодинамики для неравновесных процессов.
- •Уравнение I закона термодинамики для потока вещества (вывод, основные допущения, понятие входящих в уравнение величин).
- •Понятие идеального газа. Уравнение состояния идеального газа. Газовые постоянные. Термические коэффициенты идеального газа.
- •Понятие теплоемкости. Виды теплоемкости. Изохорная и изобарная теплоемкость, их связь.
- •Расчет адиабатного процесса с учетом зависимости теплоемкости от температуры. Функции и .
- •Политропный процесс. Соотношение между термическими параметрами в политропном процессе. Расчет работы расширения и теплоты в политропном процессе.
- •Основные характеристики смеси идеальных газов. Свойства смеси. Закон Дальтона. Закон Амага.
- •Понятие об обратимых и необратимых процессах. Примеры необратимых процессов. Причины необратимых процессов. Формулировки II закона термодинамики.
- •Круговые процессы или циклы. Прямой обратимый цикл Карно. Обратный обратимый цикл Карно. Характеристики эффективности циклов.
- •Цикл Карно. Кпд цикла Карно. Теорема Карно.
- •Понятие энтропии. Интеграл Клаузиуса. Свойства энтропии.
- •Вывод формулы для расчета изменения энтропии смеси газов.
- •-Диаграмма. Взаимное расположение изобары и изохоры в -диаграмме. Взаимное расположение в -диаграмме изобар различных давлений и изохор различных объемов.
- •Понятие среднеинтегральной температуры подвода (отвода) теплоты. Следствие теоремы Карно (вторая теорема Карно).
- •Изменение энтропии в необратимых процессах. Понятие энтропии изолированной системы.
- •Статистический характер II закона термодинамики. Термодинамическая вероятность. Взаимосвязь энтропии и термодинамической вероятности. Ограниченный характер II закона термодинамики.
- •Понятие эксергии. Эксергия неподвижной системы (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия потока вещества (графическое представление и вывод формулы).
- •Понятие эксергии. Эксергия источника теплоты с постоянной и переменной температурой. Эксергетическая функция.
- •Потери эксергии в необратимых процессах. Формула Гюи-Стодола. Эксергетический коэффициент полезного действия. Примеры вычисления эксергетического кпд.
- •Характеристические функции (определение, соответствующие им независимые переменные). Частные производные характеристических функций разных порядков.
- •Отличия свойств реальных газов от идеальных. Тройная точка, критическая точка. Фазовая -диаграмма для нормальных и аномальных веществ.
- •Условия фазового равновесия (вывод). Правило фаз Гиббса (примеры применения).
- •Вывод и физический смысл уравнения Клапейрона-Клаузиуса.
- •Основные термодинамические процессы с реальными газами: изотермический, изобарный, изохорный процесс. Определение теплоты и работы в процессах. Построение процессов в диаграммах .
- •Обратимый и необратимый адиабатный процесс реального газа. Расчет работы расширения и технической работы.
- •Адиабатное дросселирование. Представление процесса дросселирования водяного пара в -диаграмме. Коэффициент Джоуля-Томпсона.
- •Дифференциальное и интегральное уравнения адиабатного дроссель-эффекта. Кривая инверсии, ее уравнение и представление в -диаграммах.
- •Зависимость изобарной теплоемкости реального газа в однофазной области от температуры и давления.
- •Уравнение Ван-дер-Ваальса. Физический смысл поправок в его составе. Возможные решения уравнения. Устойчивые и неустойчивые состояния вещества.
- •Вириальное уравнение состояния. Вириальные коэффициенты, способы их определения.
- •Тепловая теорема Нернста. Третий закон термодинамики.
- •Следствия III закона термодинамики.
Техническая термодинамика. Экзаменационная программа 2020
-
Термодинамика. Термодинамическая система, ее виды. Понятие равновесной и неравновесной термодинамической системы. Термические коэффициенты.
Термодинамика – наука, изучающая законы превращения энергии в различных сопровождающихся тепловыми эффектами физических, химических и других процессах.
Термодинамическая система – совокупность тел, которые могут энергетически взаимодействовать между собой и с другими телами и обмениваться с ними веществом.
Виды термодинамических систем:
-
Открытая система
 ,
,
 ,
,
 ;
;
-
Закрытая система
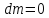 ,
,
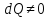 ,
,
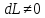 ;
;
-
Адиабатная система
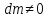 ,
,
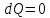 ,
,
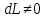 ;
;
-
Изолированная система
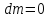 ,
,
 ,
,
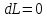 .
.
Равновесная термодинамическая система – система при постоянных внешних условиях с неизменными во времени термодинамическими параметрами. В такой системе отсутствуют потоки вещества и теплоты.
Реальные процессы протекают при нарушении равновесия между системой и окружающей средой, при этом возникают потоки теплоты и вещества внутри системы. Такая система называется неравновесной.
Термические коэффициенты:
-
Изобарный коэффициент расширения
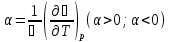 ;
;
-
Изотермический коэффициент сжатия
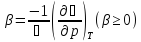 ;
;
-
Изохорный коэффициент давления
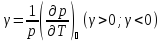 .
.
Взаимосвязь термических коэффициентов:
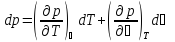 ,
,
 ,
,
 ,
,
 ,
,
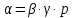 .
.
-
Функции состояния и функции процесса. Понятие теплоты и работы. Понятия равновесного и неравновесного процесса.
Функция состояния – величина, значение которой определяется состоянием системы, не зависимо от того, каким путем пришла система в это состояние.
Свойства функций состояния
 – функция состояния,
– функция состояния,
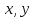 – параметры,
– параметры,
-
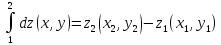 ,
, -
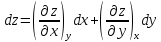 ,
, -
 ,
, -
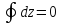 .
.

Функция процесса – величина, значение которой зависит от вида процесса, изменения состояния системы.
Теплота Q – количественная мера неупорядоченного движения, передаваемого через границы системы.
Работа L – количественная мера упорядоченного движения, передаваемого через границы системы.
Q и L проявляются только в процессе, в состоянии системы они отсутствуют.
Процесс является равновесным, если параметры системы изменяются физически бесконечно медленно и система все время находится в равновесных состояниях.
Процесс неудовлетворяющий этому условию является неравновесным.
-
Первый закон термодинамики. Принцип эквивалентности теплоты и работы. Опыт Джоуля.
I закон термодинамики: энергия не может быть создана или уничтожена, она лишь переходит из одной формы в другую в различных физических процессах.
Принцип эквивалентности: при затрате одного и того же количества работы всегда выделяется одно и то же количество теплоты, то есть переход энергии из одной формы в другую подчиняется строгой количественной закономерности.
Опыт
Джоуля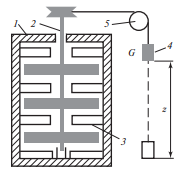
Цель: установление соотношения между работой, затрачиваемой при выделении теплоты, и количеством выделенной теплоты.
В теплоизолированный медный сосуд 1, заполненный водой, погружена мешалка 2, снабженная лопатками. К стенкам сосуда также прикреплены лопатки 3, затрудняющие движение воды при вращении мешалки. Мешалка приводится во вращение посредством опускания связанного с ней тросом через блок 5 груза 4 весом G. При опускании на высоту Δz работа, производимая грузом (и, следовательно, мешалкой), равняется убыли потенциальной энергии груза GΔz. Теплота, выделившаяся в сосуде с водой, вычисляется по повышению температуры воды, измеряемой термометром
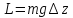 ,
,
 .
.
Джоуль установил, что между затраченной работой L и количеством полученной теплоты Q существует прямая пропорциональность:
 ,
,
где A – коэффициент пропорциональности. Джоуль нашел, что коэффициент пропорциональности A всегда сохраняет одно и то же значение независимо от способа получения теплоты, вида работы, температуры тела и т.д.
-
Формулировки и аналитические выражения I закона термодинамики. Энергия и работа, их виды.
Формулировки I закона термодинамики:
-
Теплота, подведенная к термодинамической системе, расходуется на увеличение энергии этой системы и совершение работы;
-
Вечный двигатель I-го рода невозможен, то есть невозможно производить работу, не подводя теплоту, энергию извне.
Аналитические выражения I закона термодинамики:
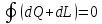 ,
,
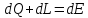 ,
,
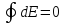 ,
,
 .
.
Внутренняя энергия – суммарная энергия частиц, составляющих систему. Это энергия всех видов движения и взаимного положения частиц.
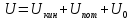 ,
,
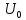 –
внутренняя энергия
при температуре абсолютного нуля,
–
внутренняя энергия
при температуре абсолютного нуля,
 ,
,
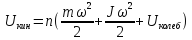 ,
,
 – число частиц,
– число частиц,
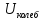 – средняя кинетическая
энергия одной частицы при колебаниях.
– средняя кинетическая
энергия одной частицы при колебаниях.
Работа – энергия, передаваемая одним телом другому при их взаимодействии.
Для всех видов работ:
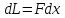 ,
где F
– обобщенная сила, x
– обобщенная координата,
,
где F
– обобщенная сила, x
– обобщенная координата,
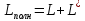 ,
L
– работа расширения,
,
L
– работа расширения,
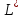 – другие виды работ (в термодинамических
системах
– другие виды работ (в термодинамических
системах
 ).
).
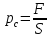 ,
,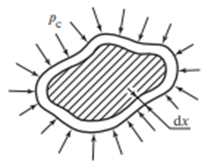
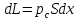 ,
,
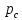 – внешнее давление,
– внешнее давление,
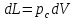 ,
,
 ,
где p
–давление внутри системы,
,
где p
–давление внутри системы,
 – работа расширения
системы.
– работа расширения
системы.
