
- •Федеральное агентство по образованию
- •Гидродинамика и массообмен в газожидкостных потоках
- •Введение
- •1.1. Описание схемы экспериментальной установки и принципа работы ксиа
- •1.1.1. Описание конструкции модели ксиа и принципа
- •1.1.2. Описание экспериментальной установки
- •1.3. Методики проведения экспериментов
- •1.3.1. Методика определения условий устойчивой работы ксиа
- •1.3.2. Методика определения производительности ксиа
- •1.3.3. Методика экспериментального определения
- •2.1.1. Описание схемы экспериментальной установки
- •2.2. Методика проведения экспериментов
- •2.3. Обработка результатов эксперимента
- •3.2. Описание экспериментальной установки
- •Методика проведения работы
- •Порядок выключения установки
- •3.3. Методика отбора проб из газожидкостной смеси и расчет концентрации растворенного газа в жидкости
- •3.4. Определение концентрации растворенного диоксида углерода в воде
- •Методика определения объемного коэффициента массоотдачи в жидкой фазе в нисходящем потоке
- •4.2. Описание экспериментальной установки и методики проведения экспериментов
- •Содержание
- •Гидродинамика и массообмен в газожидкостных потоках
3.4. Определение концентрации растворенного диоксида углерода в воде
Для определения малых концентраций растворенного в воде диоксида углерода (менее 1%) рекомендуется применять "бариевый" метод, который успешно используется при определении концентрации растворенного диоксида углерода в кефире, кисломолочных заквасках, пивобезалкогольных напитках.
Схема установки для определения концентрации диоксида углерода в пробе жидкости показана на рис. 9. Она состоит из пробирки 1 с 0,1 н. раствором гидрата окиси бария Ва(ОН)2, пробирки 2 с исследуемой пробой и микрокомпрессора 3.
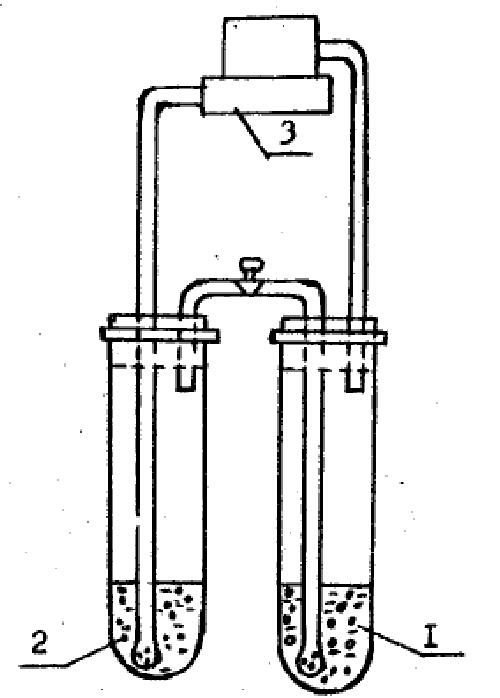
Рис. 9. Установка для определения концентрации растворённого
диоксида углерода в воде
В тщательно промытую пробирку 1 наливают 40 мл 0,1 н. раствора Ва(ОН)2 и закрепляют в установке. Затем в пробирку 2 переносят 16 мл отобранной жидкости, закрепляют эту пробирку на установке и пускают микрокомпрессор 3. Воздух, нагнетаемый микрокомпрессором, барботирует через пробу жидкости и вызывает десорбцию диоксида углерода из раствора, который вместе с воздухом поступает в пробирку с Ва(ОН)2. Здесь диоксид углерода поглощается раствором, вступая с ним в химическую реакцию, Ва(ОН)2+СО2 = = ВаСО3+Н2О.
Барботаж производится в течение 20 мин. После этого пробирку 1 снимают, а остаток Ва(ОН)2 оттитровывают раствором соляной кислоты в присутствии фенолфталеина (перед титрованием в пробирку 2 необходимо добавить две капли фенолфталеина для окраски раствора в ярко-малиновый цвет). Кислота добавляется до тех пор, пока раствор в пробирке 2 не обесцветится. Количество миллилитров кислоты, пошедшей на титрование V1, записывают.
Для определения концентрации диоксида углерода в пробе необходимо знать, какое количество кислоты идет на титрование 40 мл чистого раствора Ва(ОН)2 без углекислоты, т.е. объем холостой пробы Vx. Содержание диоксида углерода в пробе определяют по формуле, кг/кг
![]() , (3.10)
, (3.10)
где
![]() – титр соляной кислоты; 16 – объем
жидкости в пробир-
ке 2, мл.
– титр соляной кислоты; 16 – объем
жидкости в пробир-
ке 2, мл.
Методика определения объемного коэффициента массоотдачи в жидкой фазе в нисходящем потоке
1. Объемный коэффициент массоотдачи, соответствующий заданному режиму работы, определяют по уравнению, с-1
![]() .
(3.11)
.
(3.11)
2. Количество поглощенного газа в единицу времени (скорость абсорбции) находят по уравнению, кг/с
![]() .
(3.12)
.
(3.12)
3. Среднюю движущую силу определяют по уравнению (3.8).
4. Объем газожидкостной смеси
![]() ,
(3.13)
,
(3.13)
где Нсм – высота
газожидкостной смеси от точки входа
струи в смесь до точки отбора пробы, или
расстояние между двумя последовательными
точками отбора проб (измеряется линейкой),
м ;
![]() – внутренний диаметр трубы, м.
– внутренний диаметр трубы, м.
5. Равновесные концентрации определяются по уравнению, кмоль/кмоль
![]() ,
,
![]() .
(3.14)
.
(3.14)
6. Константу Генри Е находят из табл. 3.1 в зависимости от температуры.
7. Давление газа начальное
![]() ,
(3.15)
,
(3.15)
где Р0 и Ризб – атмосферное и избыточное давление (Р0 – определяют по барометру, а Ризб – по манометру 12 (рис. 7), Па.
8. Давление в газовой фазе конечное, Па
![]() ,
(3.16)
,
(3.16)
где ж –
плотность жидкости, кг/м3;
![]() – гравитационная постоянная
(
– гравитационная постоянная
(![]() = 9,81), м/с2;
= 9,81), м/с2;
![]() – высота слоя жидкости в восходящем
потоке.
– высота слоя жидкости в восходящем
потоке.
Учитывая незначительное газосодержание в восходящем потоке, для упрощения, принимают
![]() ,
,
где
![]() – высота столба газожидкостной смеси
от сечения в месте установки пробоотборной
трубки до выхода смеси из восходящей
трубы.
– высота столба газожидкостной смеси
от сечения в месте установки пробоотборной
трубки до выхода смеси из восходящей
трубы.
9. Равновесная концентрация (в массовых долях), кг/кг:
начальная
![]() ;
(3.17)
;
(3.17)
конечная
![]() ,
(3.18)
,
(3.18)
где
![]() – молекулярная масса диоксида углерода,
кг/кмоль;
– молекулярная масса диоксида углерода,
кг/кмоль;
![]() – сумма молекулярных масс воды и диоксида
углерода, кг/кмоль
– сумма молекулярных масс воды и диоксида
углерода, кг/кмоль
![]() ;
(3.19)
;
(3.19)
![]() .
(3.20)
.
(3.20)
Здесь
![]() – молекулярная масса воды, равная 18.
– молекулярная масса воды, равная 18.
Начальная и конечная рабочие концентрации Сн и Ск находятся по уравнению (3.10).
В нисходящем потоке начальная концентрация Сн равна концентрации растворенного в водопроводной воде диоксида углерода, т.е. Ск = Св .
Необходимо учесть, что в водопроводной воде всегда содержится определенное количество растворенного газа, поэтому следует оттитровать пробу воды.
Результаты измерений записывают в табл. 3.2, а результаты расчетов – в табл. 3.3.
По результатам экспериментов необходимо
построить графическую зависимость
![]() и получить уравнение, описывающее эту
зависимость.
и получить уравнение, описывающее эту
зависимость.
Таблица 3.2
|
№ опыта
|
Qж, м3/с |
dтр, м |
Нсм, м |
t, °С |
Р0, Па |
Ризб, Па |
Vx, мл |
VВ, мл |
V1, мл |
V2, мл |
V3, мл |
Нж, м |
|
1 2 3
|
|
|
|
|
|
|
|
|
|
|
|
|

Таблица 3.3
|
Рн, Па |
Рк, Па |
кг/кг |
кг/кг |
кг/кг |
кг/кг |
VP, м3 |
кг/кг |
М, кг/с |
bVж, с -1 |
|
|
|
|
|
|
|
|
|
|
|

ЛАБОРАТОРНАЯ РАБОТА 4
Определение удельной поверхности контакта фаз
химическим методом
Цель работы: Определение удельной поверхности контакта "сульфитным" методом и получение зависимости удельной поверхности контакта фаз от подводимой к газожидкостной смеси энергии.
4.1. Общие положения
В экспериментальной практике определения удельной поверхности контакта фаз а получили широкое распространение химические методы. Суть этих методов заключается в том, что в качестве модельной среды используются газ или одни из его компонентов (например, кислород, содержащийся в воздухе) и жидкость, содержащая в своем составе вещество, вступающее в необратимую химическую реакцию с молекулами непереносимого газа. Протекание химической реакции в процессе абсорбции оказывает влияние как на равновесие между фазами, так и на скорость абсорбции. При проведении в жидкой фазе химической реакции между растворенным переносимым компонентом и активной составляющей жидкостной фазы, часть переносимого вещества переходит в связанное состояние, и концентрация свободного переносимого газового компонента в жидкости понижается. Такое понижение приводит к увеличению разности концентраций и ускорению абсорбции в жидкой фазе по сравнению с физической абсорбцией. Это ускорение тем больше, чем выше скорость химической реакции, т.е. чем быстрее молекулы переносимого вещества переходят в связанное состояние. При очень значительных скоростях реакции ускорение абсорбции может быть настолько высоким, что сопротивление массопереносу в жидкой фазе становится равным нулю.
Основной принцип химических методов определения УПКФ заключается в измерении скорости абсорбции, сопровождающейся химической реакцией известной кинетики. Скорость химической реакции выбирается такой, чтобы исключить влияние на массообмен гидродинамики жидкой фазы. Это достигается использованием быстрых химических реакций, которые тщательно подбираются для каждой конструкции исследуемого аппарата.
В настоящее время наиболее изученной модельной системой для определения УПКФ химическим методом является система кислород воздуха–водный раствор сульфита натрия. При взаимодействии молекул кислорода воздуха с молекулами сульфита натрия происходит образование сульфата натрия
2Na2SO3 + O2 = 2Na2SO4.
Для ускорения проведения химической реакции, т.е. для получения быстрой химической реакции в раствор вводится катализатор CоSO4.
