
Тема II
Репликация и транскрипция вирусных геномов посредством днк-зависимого синтеза рнк.
Лекция 9
Репликация и транскрипция ретровирусов
Крупные вирусы, Ø 100 нм, обладающие мембранной оболочкой. Единственная группа вирусов с диплоидным геномом: содержат две одноцепочечные +РНК длиной около 10000 нт кэпированные и полиаденилированные. Концы молекул РНК имеют сайты димеризации. В вирусной частице обнаруживаются также несколько видов тРНК, один из которых специфичен для определенных групп ретровирусов. Вместе с РНК в вирусной частице содержится обратная транскриптаза (ревертаза) – фермент, осуществляющий синтез РНК на матрице ДНК. Ниже представлена схема воспроизведения генома ретровирусов.
-ДНК


+РНК



± ДНК
Геномы ретровирусов можно разделить на простые и сложные. В простых геномах содержатся гены, кодирующие белки капсида (gag), ферменты, необходимые для размножения вируса: полимеразу, интегразу (pol), и белки оболочки (env). В сложных геномах помимо перечисленных генов, содержатся дополнительные, как правило, регуляторные гены. Например, у вируса клеточного лейкоза на – цепи закодирован регулятор транскрипции.
При заражении клетки внутрь проникает рибонуклеопротеид. Ревертаза и РНК изолированы от цитоплазмы белковой оболочкой капсида.
Ревертаза ретровирусов. Обнаружена тридцать лет назад. Обладает активностями
1)ДНК-зависимой РНК-полимеразы;
2)ДНК-зависимой ДНК-полимеразы;
3)РНКазыН;
4)интегразы.
По структуре ревертаза похожа на клеточную ДНК-зависимую ДНК-полимеразу. В экспериментальных условиях удается заставить ДНК-полимеразы синтезировать ДНК на матрице РНК, но в физиологических условиях ДНК-полимеразы специфичны к матрице ДНК, тогда как ревертаза к матрице не специфична.
Фермент функционирует в виде гетеродимера; обе субъединицы, являются сплайсформами и отличаются только длиной N-концевого домена.
Синтез нуклеиновой кислоты ревертаза осуществляет с помощью затравки. Как решается проблема репликации 3’-конца?
Рассмотрим механизм репликации ретровирусов.
Общая структура +РНК ретровирусов

5’ 3’





U3
r
r U5 PBS
PBS – Primer Binding site
r – концевой повтор длиной 12 – 250 нт.
U3 – уникальная для 3’-конца последовательность длиной 20(?)-1200 нт.
U5 – уникальная для 5’-конца последовательность длиной 80 – 200 нт.
Синтез первой цепи ДНК происходит внутри капсида, и праймером для ревертазы служит тРНК, которая комплементарно связывается с участком PBS. У каждой группы ретровирусов в качестве праймера используется определенная, специфичная для этой группы тРНК. Белок капсида обладает РНК связывающей и РНК-хеликазной активностями, он расплавляет тРНК, чем способствует ее отжигу на PBS. В отжиге тРНК может участвовать соответствующая аминоацил-тРНК-синтетаза, которая иногда захватывается вирусом. В случае вируса птичьей саркомы показано, что тРНК может взаимодействовать и с другими участками генома. Ниже приведена модель такого взаимодействия. Считается, что при этом стабилизируется расплавленное состояние PBS.

PBS




_

Результатом удлинения затравки является
фрагмент ДНК длиной ~ 100 нт. Синтез идет
до конца матрицы – run
off. (strong stop DNA).
Этот фрагмент является мажорным
продуктом работы ревертазы.
r
U5
r
U5






+

_
После синтеза фрагмента ДНК ревертаза
проявляет активность РНКазы Н и удаляет
РНК в гетеродуплексе с ДНК, кроме участка
связывания тРНК.

r
U5







+
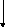
_
I прыжок. 3’-конец
фрагмента ДНК комплементарен 5’-концу
РНК (т.к. это участок r),
поэтому происходит гибридизация этих
участков. На схеме это выглядит как
прыжок.

r
U5



+

_
3’-конец фрагмента ДНК служит затравкой
для ревертазы. Синтезируется длинный
фрагмент ДНК.
U3
r U5



+

_
Ревертаза вновь проявляет активность
РНКазы Н, но удаляет не всю РНК: остается
участок, богатый пуринами, (полипуриновый
тракт)
U3
r U5

P
рр
+


_
Полипуриновый тракт используется как
затравка. В ходе синтеза ДНК происходит
смена матрицы – ревертаза переходит
на тРНК. Однако, фермент останавливается
на метилированных основаниях (DNA
strong stop) и
может синтезировать только участок
PBS . U3
r U5


рр U3
r U5 PBS PBS

+

РНКазаН удаляет тРНК и полипуриновый
тракт. Удаление полипуринового тракта
происходит хитрым образом: ревертаза
синтезирует короткий фрагмент ДНК
(около 16 н.т.), возвращается и разрывает
связь между первым дезоксинуклеотидом
и последним нуклеотидом тракта.
_ U3
r U5

U3
r U5 PBS PBS
+

_ U3
r U5
II прыжок.
Фрагмент + цепи ДНК за счет PBS
«перепрыгивает» на 3’конец –цепи и
происходит достройка обоих цепей.
Образуется линейная двуцепочечная
ДНК.
U3
r U5 PBS

+
Последний этап синтеза д.ц.ДНК можно представить иначе, если принять что происходит «циклизация» -цепи за счет фрагмента + цепи.
U3 r U5
PBS
U3 r U5
PBS

В пользу этой схемы говорят данные об обнаружении кольцевых форм ДНК, причем двух типов.
U3 r U5


U3 r U5
U5 r U3
Полагают, что причиной их появления может быть рекомбинация между участками r. Роль кольцевых форм в цикле воспроизводства ретровирусов не ясна.
Отступление. Давно замечено, что существуют пермиссивные (чувствительные) и непермиссивные (устойчивые) по отношению к ретровирусам клетки. Устойчивость связана с наличием фермента – дезаминазы дезоксицитидиловых нуклеотидов (APOBEC 3G). Этот фермент обусловливает большую изменчивость иммуноглобулинов и аполипопротеина. У ретровирусов существует защита от этого фермента – белок VIF. Он имеет убиквитинлигазную активность и инактивирует дезаминазу, направляя ее с помощью убиквитина в протеасому. VIF также блокирует включение APOBEC 3G в капсид. Если по каким-либо причинам ген этого белка не экспрессируется, то вирус не размножается в клетках, содержащих APOBEC 3G. Другой ген устойчивости к дезаминазе кодирует урацил-ДНК-гликозилазу, выщепляющую продукты ее действия.
Известно, что у ретровирусов высокая степень изменчивости, что может быть обусловлено действием дезаминазы и высокой частотой рекомбинации (поскольку геном диплоиден, то ревертаза может менять матрицу, переходя от одной цепи к другой).
Непонятно как размножаются лентивирусы, не имеющие гена vif.
Следующая стадия цикла размножения ретровирусов – интеграция в геном клетки-хозяина.
В цитоплазме находится прединтеграционный комплекс, содержащий интегразу, белок М и т.д, только необходимо проникнуть в ядро. Поскольку комплекс большой, то пройти через ядерные поры не удается, поэтому некоторые ретровирусы могут интегрироваться в геном только когда ядерная мембрана разрушена, т.е. когда клетка делится. Однако, HIV может размножаться и в неделящихся клетках. Специальный вирусный белок VPR взаимодействует с системой импортинов (в частности с кариофилином) и увеличивает сродство к М-белку комплекса, имеющего аж два NLS сигнала. Для транспорта привлекаются шапероны, например HSP70.
Механизм интеграции.
Осуществляется интегразой. Ее функцию может выполнять полимераза или это отдельный белок, функционирующий в виде тетрамера. В последнем случае с каждым концом ДНК вируса, связывается по димеру интегразы. Интеграции способствуют следующие факторы: 1)начало транскрицпии; 2)необычные структуры ДНК (деформации спирали).
Интеграция происходит неспецифически, без инверсии и сопровождается двумя геномными изменениями: концы вирусной ДНК теряют по ТТ и фланкируются повторами клеточной ДНК.
Перед встраиванием димеры интегразы объединяются и, таким образом, за счет белок-белковых взаимодействий ДНК нековалентно циклизуется. Интеграза удаляет с 3'-концов по ТТ, это механизм предотвращения самоинтеграции.
Изучение in vitro: иметь плазмиду со встроенным фагом и смесь нужных белков.
ДНК вируса компактизована с участием клеточных белков: HMG A1, BAF (Barrier for Autointegration Factor).
Приблизившись к участку геномной ДНК хозяина, интеграза вносит одноцепочечные разрывы в обе цепи на расстоянии 4-6 нт. Происходит соединение ДНК вируса и клетки, репарация бреши, с удалением 5'-концевых AA.





CATT
3' 5' AATG
GTAA
5' 3' TTAC
3' 5'
5' 3'








5' 3'
3' 5'





U3
r U5 U3
r U5









Транскипция аденовирусов.
Основные элементы, необходимые для транскрипции есть изначально, но синтез мРНК начинается только после интеграции вируса. Может влияет структура?
Транскрипция идет вправо от r до r. Регуляторные элементы (TATA, инициатор UAS) находятся в U3, но почему работает только левый промотор, а правый молчит? Полиаденилирование также происходит только на правом конце.
Есть предположение, что влияют внутригеномные элементы, такие элементы известны в случае лентивирусов у других пока не известно. Может влияет клеточное окружение.
Если ввести сильный терминирующий сигнал между правым и левым промоторами, то включается правый. Правый промотор "знает", что делает левый. Видимо, транскрипция с левого промотора блокирует работу правого промотора. Проблема изучена плохо.
Полиаденилирование.
Вирус рака молочных желез.
Уровень транскрипции зависит от гормонального состояния организма, например, от количества глюкокортикоидов.
Энхансерные элементы зарепрессированы и их активация происходит при лактации. В активации участвуют oct1, oct2, remodeling factors, CDP (CC displasment protein), блокирует взаимодействие рецепторов глюкокортикоидов (цитоплазматические белки) с энхансерными элементами.
HIV.
TAT белок (TransAcTivator) 86 а.к., содержит два домена: РНК-связывающий и активирующий.
На 5’-конце в R области транскриптов имеется несовершенная шпилька – элемент TAR. Присоединившись к этой структуре белок активирует транскрипцию.
Петля на самом деле представляет
собой организованную структуру. Размер
выпетливания (bulch) 3 нт.




TAT привлекает к TAR позитивный фактор элонгации транскрипции – pTEF, в факторе находятся циклин-зависимая протеинкиназа – CDK9 и ее активатор – циклин Т1. Показано, что при фосфорилировании РНК-полимеразы II увеличивается ее процессивность. Среди киназ, фосфорилирующих РНК-полимеразу II, обнаружена TAK – TAT activated kinase. ТАТ привлекает также компонент ситемы перемоделирования хроматина р300/СВР (ацетилаза).
Каким образом связывание TAT-белка приводит к активации транскрипции? Предположено, что когда появляется эта шпилька, белок связывется с ней и привлекает факторы транскрипции. Таким образом, облегчается синтез последующих мРНК. Активация промотора позади транскрипционного комплекса.
В отсутствии ТАТ белка TAR-элемент взаимодействует с РНК-полимеразой и это снижает ее активность.








ТАТ может действовать независимо от TAR-элемента.
Он активирует PKR – интерферон индуцируемую протеинкиназу, фосфорилирующую α-субъединицу фактора инициации трансляции – eIFα, она также фосфорилирует IκB – ингибитор фактора транскрипции NFκB. В фосфорилированной форме ингибитор направляется на разрушение по убиквитин-протеосомальному пути. Фактор транскрипции из цитозоля импортируется в ядро, где активирует ряд генов, в том числе и гены вируса HIV.
ТАТ активирует кэпирующий комплекс и тем самым стимулирует кэпирование мРНК.
Есть данные о том, что ТАТ стимулирует обратную транскрипцию.
ТАТ обладает последовательностью, позволяющей ему войти в клеткку. Он используется как шаттл-белок для транспорта других белков.
ТАТ взаимодействует с белками тубулина, нарушая архитектуру цитоскелета, он провоцирует клетку уйти в апоптоз.
ТАТ стимулирует посадку тРНК на PBS-сайт.
ТАТ участвует в упаковке вирусных частиц.
Другие регуляторы.
Nef. Вкючает киназный каскад, работает только в системе целого организма.
VPR. Стимулирует транскрипцию ДНК неинтегрировавшегося вируса. Связывается с р300/СВР.
HTLV-1(вирус клеточного лейкоза).
