
- •3.Гесс заңы,оны термодинамикалық тұрғыдан негіздеңіз.Ішкі энергия және энтальпия,олардың өзара байланысын теңдеуді қорытыңыз.
- •4. Гесс заңының салдары бойынша химиялық реакция жылу эффектісін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз
- •5. Заттыңжылусыйымдылығы, Меншікті және нақты жылусыйымдылықтар, Орташа және нақты жылусыйымдылықтар олардың өзара байланысын көрсететін теңдеуді қортыңыз
- •6.Тұрақты қысым және тұрақты көлем кезіндегі жылусыйымдылықтар, олардың өзара байланысын көрсететін теңдеуді қортыңыз. Заттардың жылусыйымдылығының температураға тәуелділігін сипаттаңыз.
- •9.Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз.
- •10. Идеал газдар қатысымен өтетін әр түрлі процестерге термодинамиканың 1-ші заңының қолдануын көрсетіңіз.
- •11. Термодинамиканың екінші заңы, оның анықтамалары және математикалық өрнектерін келтіріңіз. Қайтымды және қайтымсыз процестердің энтропиясының өзгерісін көрсететін теңдеуді келтіріңіз.
- •12. Карно циклі, оның пайдалы әсер коэффициентін сипаттаңыз. Карно теоремасы. Энтропия, оның физикалық мағынасын ашыңыз.
- •13.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдануын көрсетіңіз. Планк постулаты. Заттың абсолютті энтропиясының температураға тәуелділігн сипаттаңыз
- •15.Термодинамикалық потенциалдар, олардың процесс бағытының критериі ретінде қолдануын көрсетіңіз. Сипаттамалық функциялар мен олардың табиғи айнымалыларын сипаттаңыз.
13.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдануын көрсетіңіз. Планк постулаты. Заттың абсолютті энтропиясының температураға тәуелділігн сипаттаңыз
1.Оқшауланған
жүйеде жүйенің энтропиясы нольден үлкен
болса,
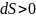 ,
процесс өздігінен тура бағытта жүреді.
,
процесс өздігінен тура бағытта жүреді.
Жүйе
тепе-теңдікке келгенде процестер
міндетті тоқтап, энтропия өзінің максимал
мәніне ие болады
 .
Сөйтіп, оқшауланған жүйенің тепе-теңдік
күйде дегеніміз энтропия мәні максималға
жетіп, одан әрі өзгермеуі болып табылады.
.
Сөйтіп, оқшауланған жүйенің тепе-теңдік
күйде дегеніміз энтропия мәні максималға
жетіп, одан әрі өзгермеуі болып табылады.
Егер жүйе айналадағы ортамен жылу не жұмыс алмасу арқылы әсерлесетін болса, онда өтетін процестердің нәтижесінде энтропия өсуі де, кемуі де мүмкін. Сондықтан процестің өту мүмкіндігі мен оның бағыты туралы мәліметтер алу үшін барлық қатысатын денелерді жүйеге кіргізу керек, яғни жүйені оқшауланған күйде алу қажет.
2.Планк постулаты бойынша температурасы абсолюттік нольге жеткенде кристалдық заттардың энтропиясы нольге тең болады. Бұл постулаты Планк 1912ж ұсынған.
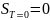
Ал
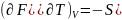 ,
осыдан T=0
болғанда
,
осыдан T=0
болғанда
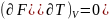 және
және

Температура төмендегенде энтропия асимптоталық түрде өзінің шегіне, яғни кез келген басқа температурадағы абсолюттік мәнін табуға болады.
3.Калорикалдық шамаларды біле тұра энтропияның абсолюттік мәнін есептеуге болады. Үшінші заң энтропияны есептеудің жолдарын береді. Ол үшін заттың абсолюттік нольден бастап берілген температураға дейінгі жылу сыйымдылықтарын және алынған температура аралығында байқалатын заттың агрегаттық өзгерістерінің жылу эффектілерін білу керек. Энтропия қысым мен температураның функциясы болсын дейік, яғни
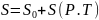
Бұл
жерде
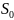 – абсолютті нольдегі энтропия. Планк
постулаты бойынша
– абсолютті нольдегі энтропия. Планк
постулаты бойынша
 ,
сондықтан жоғарыдағы теңдеу былай
жазылады:
,
сондықтан жоғарыдағы теңдеу былай
жазылады:

Осы
функция белгілі болса, берілген қысым
мен температурадағы энтропияның
абсолюттік мәнін есептеп табуға болады.
Мысалы, 1 моль заттың температурасын
0-ден Т
дейін көтергенде оның энтропиясы

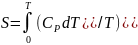
Ал
агрегаттық өзгеріс кезіндегі энтропияның
өзгерісі сол агрегаттық өзгерістің
жылу эффектісінің
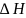 температураға бөлгеніне тең:
температураға бөлгеніне тең:

Осы айтылғандарды қолдана отырып энтропияның абсолюттік мәнін мына формула арқылы есептейді:
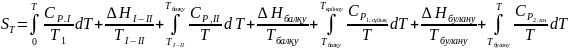
Планк постулатын ескере отырып T – температурада 1 моль кез келген газ күйдегі заттың энтропиясының мәнін есептеу үшін абсолюттік нольден T - температураға дейін затты қыздырғандағы оның энтропия өзгерістерін табуымыз керек. Бұл жерде қатты затты қыздырамыз, қатты агрегаттық күйден сұйық, одан кейін газ күйіне дейін қыздыру арқылы ауыстырамыз. Осы процестердегі энтропия өзгерістерінің қосындысы керекті энтропияның абсолюттік мәнін береді.
14. Химиялық реакция және фазалық ауысулар энтропиясының өзгерісін есептеу. Идеал газдар қатысымен өтетін әр түрлі процестер энтропиясының өзгерісін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз.
Химиялық реакция энтропиясының өзгерісі есептеледі:
∆rS◦298=( iS◦298)өнім-(
iS◦298)б.з.
iS◦298)өнім-(
iS◦298)б.з.
∆rS◦T2=∆rS◦T1
+
I-жуықтау.
∆C◦p= const, (T1 - T2) – азболса:
∆rS◦T2=∆rS◦T1 + ∆rC◦pln(T2/T1)
II- жуықтау.
∆C◦p=f(T), (T1 - T2)– үлкен болса:
∆C◦p=∆a+∆bT+∆cT2+∆c'/T2ескеріп,
∆rS◦T2=∆rS◦T1
+ =∆rS◦T1+∆aln(T2/T1)+∆b(T2-T1)+∆c/2(T22-T12)-
∆c'/2(1/ T22-1/
T12)
=∆rS◦T1+∆aln(T2/T1)+∆b(T2-T1)+∆c/2(T22-T12)-
∆c'/2(1/ T22-1/
T12)
Фазалық өзгерістердің энтропиясы анықталады:
∆S = ∆Hфаз.өзгер./Тфаз.өзгер.
Мұнда ∆Hфаз.өзгер. – фазалық өзгерістің жылуы, Тфаз.өзгер. – фазалық өзгерістің температурасы.
Идеал газдар қатысымен өтетін әр түрлі процестер энтропиясының өзгерісін есептеу:
Бірінші және екінші заңдардың жалпы теңдеуінен:
TdS = dU+PdV
dU = CvdT
dS = (CvdT)/T+(PdV)/T
Идеал газдардың теңдеуінP=(nRT)/V жоғарыдағы теңдеуге қойғанда:
dS = (CvdT)/T+(nRT)/V
Интегралдағаннан кейін:
∆S =S2 - S1= nCvln(T2/T1)+n Rln(V2/V1)
Идеал газдар үшін Майер формуласынан Cp – Cv= R және T1/T2=V1/V2=P2/P1. Осыны қолданып соңғы теңдікті түрлендіруге болады:
∆S =nCpln(T2/T1) + nRln(P1/P2)
ЕгерT=constболса, онда:
∆S =nRln(V2/V1) = nRln(P1/P2)
Егер V=constболса, онда:
∆S =nCvln(T2/T1) = nCvln(P2/P1)
