
- •3.Гесс заңы,оны термодинамикалық тұрғыдан негіздеңіз.Ішкі энергия және энтальпия,олардың өзара байланысын теңдеуді қорытыңыз.
- •4. Гесс заңының салдары бойынша химиялық реакция жылу эффектісін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз
- •5. Заттыңжылусыйымдылығы, Меншікті және нақты жылусыйымдылықтар, Орташа және нақты жылусыйымдылықтар олардың өзара байланысын көрсететін теңдеуді қортыңыз
- •6.Тұрақты қысым және тұрақты көлем кезіндегі жылусыйымдылықтар, олардың өзара байланысын көрсететін теңдеуді қортыңыз. Заттардың жылусыйымдылығының температураға тәуелділігін сипаттаңыз.
- •9.Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз.
- •10. Идеал газдар қатысымен өтетін әр түрлі процестерге термодинамиканың 1-ші заңының қолдануын көрсетіңіз.
- •11. Термодинамиканың екінші заңы, оның анықтамалары және математикалық өрнектерін келтіріңіз. Қайтымды және қайтымсыз процестердің энтропиясының өзгерісін көрсететін теңдеуді келтіріңіз.
- •12. Карно циклі, оның пайдалы әсер коэффициентін сипаттаңыз. Карно теоремасы. Энтропия, оның физикалық мағынасын ашыңыз.
- •13.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдануын көрсетіңіз. Планк постулаты. Заттың абсолютті энтропиясының температураға тәуелділігн сипаттаңыз
- •15.Термодинамикалық потенциалдар, олардың процесс бағытының критериі ретінде қолдануын көрсетіңіз. Сипаттамалық функциялар мен олардың табиғи айнымалыларын сипаттаңыз.
9.Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз.
Реакция нәтижесінде бөлінетін немесе реакция жүру үшін берілетін жылу реакцияның жылу эффектісі деп аталады.
Реакцияның жылу эффектісін зерттейтін физикалық химияның саласын термохимия деп атайды.Термохимия еру процесі кезіндегі де жылу эффектілерін қарастырады.
Реакцияның жылу эффектісі температураға тәуелді. Бұл тәуелділікті табу үшін Qp мен Qv беретін өрнектерді тұрақты көлемде не қысымда бойынша дифференциалдайық:
Qv=U2-U1 , Qp=H2-H1 (1)
(dQv/dT)v=(dU2/dT)v-(dU1/dT)v=Cv2-Cv1 (2)
(dQp/dT)p=(dH2/dT)p-(dH1/dT)p=Cp2-Cp1 (3)
Мұнда Cv мен Cp - тұрақты көлемде не тұрақты қысымдағы мольдік жылу сыйымдылықтар, 1 немесе 2 деген индекстер реакцияға қатысатын алғашқы немесе соңғы заттар үшін алынған.
Төменгі реакция үшін:
aA+bB=dD+eE
жылу сыйымдылықтың өзгерісі
ΔCp=dCP,D+eCP,E-aCP,A-bCP,B (4)
Немесе жалпы түрде жазатын болсақ:
ΔCp=∑niCP,шық.зат - ∑niCP,түс.зат (5)
∑niCP,шық.зат-реакцияның нәтижесінде шыққан заттардың жылу сыйымдылықтарының қосындысы; ni – осы заттарға сәйкес стехиометриялық коэффициенттер; ∑niCP,түс.зат-реакцияның нәтижесінде түскен заттардың жылу сыйымдылықтарының қосындысы;
(dQp/dT)p=(dΔH/dT)p=∑niCP=ΔCP (6)
Бұл теңдеу Кирхгоф теңдеуі деп аталады. Ол Т1 мен Т2 температура аралығында жылу эффектісінің температураға байланысын көрсетеді. Т2 температурада жылу эффектісін есептеу үшін (6) тендеуді интегралдаймыз:
ΔH2=ΔH1+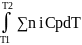 (7)
(7)
Бұл теңдеу бойынша жылу эффектісінің Т2 температурадағы мәнін табу үшін оның бастапқы Т1 температурадағы мәні белгілі болу керек және де жылу сыйымдылықтың температураға тәуелділігін Т1 мен Т2 аралығында білу қажет.
Кирхгоф формуласы үш түрлі жағдайда қолданылады:
ΔСр=0 болса, (7) формула ΔH2=ΔH1=const (8)
ΔСр нольге тең болмай тұрақты бір мәнге тең болғанда оны интегралдап шығарамыз:
ΔH2=ΔH1+ ΔСр(Т2-Т1) (9)
3)Кирхгоф теңдеуін шешу үшін жылу сыйымдылықтың температураға тәуелділігін ескереміз. Жылу сыйымдылықтың температураға тәуелділігі тәжірибе жүзінде анықталған мынадай қатармен беріледі:
ΔСр=a+bT+cT2+dT3+…. (10)
a,b,c,d-эмперикалық коэффициенттер, олар зат табиғатына байланысты;(5) теңдеуден ΔСр мәні реакцияға қатысатын заттардың жылу сыйымдылықтарының алгебралық қосындысы; (10) теңдеуді қолданып, реакция үшін ΔСр мәнін есептейміз:
ΔСр= Δa+ΔbT+ΔcT2+…. (11)
ΔСр мәнін есептегенде реакциядағы стехиометриялық коэффициенттер ескерілу керек. Осылай табылған жылу сыйымдылықтарды Кирхгоф теңдеуіне қойсақ:
ΔHT= ΔH1+ ΔaT+1/2ΔbT+1/3ΔcT2 (12)
ΔH1-интегралдау тұрақтысы. Оны химиялық реакцияның стандартты жағдайдағы жылу эффектілері арқылы анықтайды.
10. Идеал газдар қатысымен өтетін әр түрлі процестерге термодинамиканың 1-ші заңының қолдануын көрсетіңіз.
Идеал газды термодинамикалық жүйе деп қарастырайық.Идеал газдың күйін сипаттайтын Клайперон-Менделеев теңдеуі: PV=nRT (1)
Идеал газ жүйесінде берілген жылу энергиясы ұлғаю жұмысынан басқа жұмыс түрлеріне жұмсалмайды.Сонда бірінші заңның негізгі теңдеуінде ұлғаю жұмысына сәйкес өрнек алынады:
δQ=dU+PdV
Жылу сыйымдылықты қолданған кезде бұл теңдеу мынадай болып жазылады: δQ=CvdT+PdV (2)
К-М теңдеуінен бір моль газдың көлемі: V=RT/P
Оның туындысын алсақ:
(ɚ V/ɚP = -RT/P2 = -PV/P2 = -V/P (3)
Тұрақты көлемдегі жылу сыйымдылық Cv ж/е тұрақты қысымдағы CР-ның өрнектері бір-біріне ұқсамайды. Жоғарыда келтірілген теңдеулерден олардың мәндерн қарастырайық: Cv= (ɚ Q/ɚT)V=(ɚ U/ɚT)V
CР=(ɚ Q/ɚT)P =(ɚ U/ɚT)P+P(=(ɚ V/ɚT)P
ΔQ= CРdT +[(ɚ U/ɚP)T +P(=(ɚ V/ɚP)T]dP мына теңдеуге (3) теңдеуге қойсақ,ж/е (ɚ U/ɚР)Т=0 десек,себебі идеал газдарда ішкі энергия қысымға тәуелсіз ,бірінші заңның идеал газдарды сипаттайтын тағы да бір теңдеуін аламыз: δQ=CРdT-VdР (4)
(2)-теңдеулі (4) теңдеумен теңестірсек:
CvdT+PdV = CРdT-VdР (5)
К-М-тің теңдеуін дифференциал түрінде алсақ
PdV+ VdР = RdT. Мұны (5) теңдеумен салыстырғанда
PdV+ VdР = (CР - Cv) dT,яғни CР - Cv = R (6) деген өрнекті аламыз(Майер формуласы).
Бірінші заңның идеал газдар үшін қолданылатын тңдеуінің бірі: δQ =dU+PdV
Жүйеге жылу берілгенде кейбір жағдайларда жұмыс жасалмайды,яғни А=0. Бұл жағдайда берілген жылу жүйенің ішкі энергиясының өзгерісіне түгелдей жұмсалады.мысалы қатты заттың қыздыру процесін қарастыратын болсақ,қыздырған кезде оның өте аз ұлғаятындығынан ұлғаю жұмысы ескерілмейді.Яғни, бұл жерде δQ=dU.Ал кейбір жағдайларда берілген жылу түгелімен жұмыс жасауға жұмсалып,ішкі энергияны өзгертпейді,демек, δQ=dА. (2)-теңдеуді осы жағдайда алатын болсақ dU=0 тең болғанда температура өзгермеуге тиіс,яғни dТ=0.Бұл процесті изотермиялық процесс д.а.Кейбір процестерде жүйе сырттан жылу алмай,ішкі энергиясының есебінен жұмыс жасайды,бұл кезде δА=-dU.Мұндай процесс- терді адиабатты проц-р д.а.Жүйе пайдалы жұмыс жасаса,оның ішкі энергиясы азаяды.Ал жүйеге сырт- тан жұмыс жұмсалса,онда ішкі энергия өседі.Идеал газдың энергиясы тек температураға төмендеп жүйе суынады.Сырттан жылу берілмеген жағдайда δQ=0,
dU+PdV = 0.(2)-теңдеу 1 моль газ үшін:
PdV=-CvdT (7)
