
- •3.Гесс заңы,оны термодинамикалық тұрғыдан негіздеңіз.Ішкі энергия және энтальпия,олардың өзара байланысын теңдеуді қорытыңыз.
- •4. Гесс заңының салдары бойынша химиялық реакция жылу эффектісін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз
- •5. Заттыңжылусыйымдылығы, Меншікті және нақты жылусыйымдылықтар, Орташа және нақты жылусыйымдылықтар олардың өзара байланысын көрсететін теңдеуді қортыңыз
- •6.Тұрақты қысым және тұрақты көлем кезіндегі жылусыйымдылықтар, олардың өзара байланысын көрсететін теңдеуді қортыңыз. Заттардың жылусыйымдылығының температураға тәуелділігін сипаттаңыз.
- •9.Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз.
- •10. Идеал газдар қатысымен өтетін әр түрлі процестерге термодинамиканың 1-ші заңының қолдануын көрсетіңіз.
- •11. Термодинамиканың екінші заңы, оның анықтамалары және математикалық өрнектерін келтіріңіз. Қайтымды және қайтымсыз процестердің энтропиясының өзгерісін көрсететін теңдеуді келтіріңіз.
- •12. Карно циклі, оның пайдалы әсер коэффициентін сипаттаңыз. Карно теоремасы. Энтропия, оның физикалық мағынасын ашыңыз.
- •13.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдануын көрсетіңіз. Планк постулаты. Заттың абсолютті энтропиясының температураға тәуелділігн сипаттаңыз
- •15.Термодинамикалық потенциалдар, олардың процесс бағытының критериі ретінде қолдануын көрсетіңіз. Сипаттамалық функциялар мен олардың табиғи айнымалыларын сипаттаңыз.
1-БЛОК
1-сұрақ. Термодинамиканың негізгі түсініктері мен анықтамаларын сипаттаңыз.
Термодинамика температура мен жылудың және жылу мен жұмыстың өзара байланысын зерттейтін ғылым (термо грек тілінде -жылу, динамика-қозғалыс). Термодинамикада энергияның бір түрден екінші түрге айналуын қарастыру арқылы әр-түрлі құбылыстар зерттеледі.Термодинамикада зерттелетін объектіні жүйе деп атайды. Жүйе дегеніміз кеңістіктің бөліп алынған бір бөлігі. Бұл бөлік бір немесе бірнеше бөліктен тұрады. Жүйе айналадағы ортадан ойша немесе шын мәнінде алынған шектермен шектеліп бөлінеді. Жүйені құрайтын денелер өзара бір-бірімен және басқа денелермен энергия не зат алмасу арқылы әрекеттесуі мүмкін. Осындай жағдайда бұлар термодинамикалық жүйе болып саналады. Термодинамикалық жүйе айналадағы ортамен әрекеттескенде, олардың арасында жылу алмасуй байқалып, жұмыс өндіріледі. Термодинамада макроскопиялық денелер (жүйелер) қарастырылады. Денелерді құрайтын микробөлшектер жылу әсерінен ылғи да қозғалады. Жүйедегі бөлшектердің жылу қозғалыс мөлшері температура арқылы өлшенеді. Бұл жағдай термодинамиканың маңызды және негізгі тұжырымы болып, аксиома түрінде беріледі. Жылу тепе-теңдігінде барлық термодинамикалық денелерде температура бірдей болады. Мұны кейде термодинамиканың нольдік заңы деп атайды.
Термодинамикалық жүйе айналадағы ортамен жылу, не басқа энергия, зат алмасу арқылы әрекеттеспесе, ондай жүйені оқшау жүйе деп атаймыз. Жүйе өзіне тән қасиеттерімен, соған байланысты күйімен сипатталады. Егер жүйенің күйі өзгермей тұрақты болса, термодинамикалық тепе-теңдік орнаған болып табылады. Мұндай жағдайда жүйенің барлық бөліктерінде температура, зат концентрацтясы және қысымы бірдей болады. Сыртқы жағдай өзгермей жүйе тепе-теңдік күйден өздігінен шықпайды. Жүйенің термодинамикалық тепе-теңдікте болуын мынадай қарапайым мысалмен көрсетуге болады. Беті жабық ыдыстағы 1000С-қа дейін қыздырылған суды алайық. Ыдыстағы су тепе-теңдік күйде емес, себебі бөлменің температурасы 200С болуына байланысты су суй бастайды. Температураның әр-түрлі болуынан түрлі процестер, мысалы, жылу алмасу, конвекция, сәуле шығару процестері болуы мүмкін. Белгілі бір уақыттан кейін судың барлық қабаттарының температурасы айналадағы ортамен бірдей болдаы. Суда процестер тоқтап, термодинамикалық тепе-теңдік орнайды.
Жүйе гетерогенді және гомогенді болып бөлінеді. Гетерогенді жүйелер бір-бірінен шектеліл бөлініп тұратын қасиеттері бірдей емес бірнеше бөліктерден тұрады. Әрбір бөлік фаза деп аталады. Гомогенді жүйе бір фазадан тұрады. Гомогенді жүйеге мысал ретінде тұздың қанықпаған ерітіндісін келтірсек, гетерогендінің мысалы ретінде тұздың аса қаныққан ерітіндісін алуға болады.
Жүйе айналадағы ортамен энергия және зат алмасу арқылы әрекеттесетін болса, оны ашық, ал тек эенргия алмасу арқылы әрекеттесетіндерін жабық жүйелер дейміз.
2-сұрақ. Термодинамиканың 1-ші заңы, оның анықтамалары мен аналитикалық өрнектерін келтіріңіз.
Оқшауланған жүйенің ішкі энергиясы тұрақты болады.
∫dU=0 , U=const
Бұл энергия сақталу заңының мөлшерлңк сипаттамасы. Термодинамиканың бірінші заңының негізгі мағынасы тек энергия сақталуын ғана емес, сонымен қатар энергияның бір түрден екінші түрге айналу мүмкіндігін көрсетуі.
Бірінші заңның анықтамасы кейде былай деп те айтылады: энергия дененің, иә жүйенің күй функциясы. Мысалы, ішкі энегия жүйе күйін сипаттайтын параметрлердің функциясы:
U=f(P,T,V) (1)
Термодинамикада энергияның бір түрден екінші түрге ауысуы екі түрлі формада болады. Бұл формалар жұмыс және жылу. Олай болса, жүйеге берілген жылу ішкі энергияның өзгерісіне және жұмыс жасауға жұмсалады:
δQ= dU+ δA (2)
Бірінші заңға тағы да бір анықтама келтірейік: бірінші текті перпетуум мобиле (мәңгі қозғалтқыш) жасап шығаруға болмайды.
(1)-теңдеудегі үш айнымалы шаманың біреуі тұрақты десек:
U=f(V,T), P=const (3)
Ішкі энергияның өзгерісі толық дифференциал түрінде жазылғанда, оны туындылар арқылы көрсетуге болады:
dU=( )TdV+
)TdV+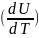 VdT
(4)
VdT
(4)
(2)-теңдеу бірінші заңның негізгі теңдеуі. Ол (4) –теңдеуді қолданғанда былай жазылады:
δQ=(∂U∕ ∂V)TdV+(∂U∕∂T)VdT+ δA (5)
δА= PdV болса:
δQ=(∂U∕ ∂V)TdV+(∂U∕∂T)VdT+ PdV (6)
Бұл теңдеудегі ұқсаса мүшелерді жинақтасақ:
δQ=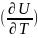 VdT+[(
VdT+[(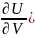 T+P]dV
(7)
T+P]dV
(7)
Егер ішкі энергия температура, қысымға тәуелді, ал көлем тұрақты болса:
U=f(P,T) (8)
Бірінші заңның теңдеуі басқадай өрнектеледі:
dU=( )PdT+
)PdT+ TdP
(9)
TdP
(9)
δQ=(∂U∕ ∂T)PdT+(∂U∕∂P)TdP+ δA (10)
(7) мен (10) теңдеулерді біріктіріп түрлендіруге болады. Ол үшін V=f(P,T)-функциясын қолданамыз. Көлем-функция болса, оның ьолық дифференцияалын туындылар арқылы жазсақ:
dV=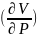 TdP+
TdP+ PdT
(11)
PdT
(11)
Мұны (7)-теңдеумен (10)-теңдеуге қоятын болсақ:
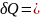 P+P
P]dT+[
P+P
P]dT+[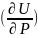 T+P
T+P )T]dP
(12)
)T]dP
(12)
Бұл келтірілген теңдеулердің бәрі термодинамикаынң бірінші заңының математикалық сипаттамасы.
Бұл келтірілген теңдеулер термолинамиканың бірінші хаңының мағынасын көрсетеді. Теңдеулерді белгілі бір жүйеге қолдану үшін соның күйін сипаттайтын функциялар белгілі болу қажет. Тек сонда ғана бұл өрнектерді нәтижелі қолдануға болады.
3.Гесс заңы,оны термодинамикалық тұрғыдан негіздеңіз.Ішкі энергия және энтальпия,олардың өзара байланысын теңдеуді қорытыңыз.
Тұрақты қысымда Qp=∆H,ал тұрақты көлемде өтетін процестерде Qv=∆U. Ішкі энергия және энтальпия термодинамикалық функциялар,яғни күй функциялары. Олардың өзгерістері жүйенің бір күйден екінші күйге келу жолдарына тәуелсіз,алғашқы және соңғы күйлеріне байланысты.Олай болса Qp және Qv(химиялық реакцияның жылу эффектілері) реакцияның жүру жолына тәуелсіз. Бұл термодинамиканың бірінші заңынан тікелей шығатын салдар. Оны Гесс заңы деп атайды. Бұл заңды 1836 жылы тәжірбие жолында ашқан орыс ғалымы Г.И. Гесс. Гесс заңы былай оқылады: Процестің жылу эффектісі процестің жүру жолына тәуелсіз,ол тек жүйенің басиапқы және соңғы күйлерімен анықталады.
Гесс заңының орындалуы мынадай екі шартпен байланысты:а)жүйеде тек көлем ұлғаю жұмысы жасалуы тиіс,ол сыртқы қысымға қарсы жұмсалатын жұмыс;б)процесс не қысым Р,не көлем V тұрақты жағдайда өтуі қажет.
Ішкі энергия және энтальпия байланысы теңдеуі. Ол үшін 1 моль идеал газ қарастырамыз:
H=U+pV; p=const
∆H=∆U+p∆V
pV=υRT
p∆V=∆υRT
∆H=∆U+∆υRT
∆υ
0
∆H
∆υ
0
∆H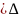 U
U
∆υ 0 ∆H U
Газ
тәріздес заттардың зат мөлшерінің
өзгерісі
 .
.
Гесс заңынан мынадай қорытындылар алуға болады:
Заттың түзілу жылуының мәні оның алғашқы заттардан алыну әдістеріне байланысты емес.
Заттың алғашқы заттарға ыдырау жылуы оның осы заттардан түзәлу жылуына тең,тек олардың таңбалары қарама - қарсы болады. (Лавуазье-Лаплас заңы)
Екі түрлі жүйедегі өтетін процестердің нәтижесінде бірдей заттар түзілетін болса,бұл процестер жылуларының айырымдары біреуінің екінші жүйеге ауысу жылуына тең болады.
4. Гесс заңының салдары бойынша химиялық реакция жылу эффектісін есептеуге мүмкіндік беретін теңдеулерді келтіріңіз
Гесс заңының негіздеп белгісіз реакциялардың жылу эффектілерін есептеуге болады. Ол үшін белгілі реакциялардың стехеометриялы теңдеулерін үйлестіруге болады. Мұнымен қатар әр түрлі химиялық реакциялардың жылу міндерін реакцияға қатысатын заттардың жану немесе түзілу жылулары арқылы есептеуге болады. Айтылған әдісті қарастырайық:
а) химиялық реакцияларды үйлестіру арқылы керекті реакцияның жылу эффектісін табу әдісі:
Берілген үш реакцияның жылу эффектілері белгілі:
1.C(графит)+O2(газ)=CO2(газ) ∆H1=-393,51кДж
2CO(газ)+ O2(газ)=CO2(газ)∆H2=-282,91кДж
O2(газ)=CO2(газ)∆H2=-282,91кДж
3.H2(газ)+ O2(газ)=H2O(газ) ∆H3=-241,57кДж
Осыларды біле тұра төменгі реакциялардың жылу эфектілерін табу керек.
4.C(графит)+ O2(газ)=CO(газ) ∆H4=?
5.C(графит)+H2O(газ)=CO(газ)+H2(газ) ∆H5=?
6.C(графит)+2H2O(газ)=CO2(газ)+2H2(газ) ∆H6=?
Қосымша берілген үш теңтеудің көмегімен төменгі үш теңдеудің жылу эффектілерін табу үшін бірінші теңдеуден екінші теңдеуді аламыз. Сонда
C(графит)+ O2(газ)=CO(газ), яғни
∆H4=∆H1-∆H2=-395,51+282,91=-110,60кДж.
Төртінші теңдеуден үшінші теңдеуді алғанда:
C(графит)-H2(газ)=CO(газ)-H2О(газ) немесе
C(графит)+H2O(газ)=CO(газ)+H2(газ). Осыдан
∆H5=∆H4-∆H3=-110,60+241,57=130,97кДж.
Үшінші теңдеуді 2-ге көбейткенде
2H2(газ)+O2(газ)=2H2O(газ).Бұл теңдеуден алатын болсақ:
C(графит)+2H2O(газ)=CO2(газ)+2H2(газ).
∆H6=∆H1-2∆H3=-395,51-2(-241,57)=89,63кДж.
б)реакцияға қатысқан заттардың жану жылуларының көмегімен реакцияның жылу эффектісін табу әдісі.
Гесс заңынан шығатын салдар бойынша реакцияның жылу эффектісі реакцияға қатысатын заттардың жану жылуларының алгебралық қосындысына тең. Заттың жану жылуы деп осы заттың оттегімен әрекеттесіп жоғары оксидтер бергендегі реакцияның жылуы алынады. Жану жылуы 1моль затқа келтіріледі. Әсіресе органикалық заттар үшін жану жылуды табу оңай болғандықтан, реакцияның жылу эффектісін жану жылуы арқылы табу жиі кездеседі. Есептерді жүргізу ыңғайлы болу үшін жану жылулар стандартты жағдайларға келтірілген, яғни алғашқы заттар және жану реакциясының өнімдері қысым 1атм болған жағдайда алынады. Қазіргі уақытта анықтамаларда жану жылулары 298,15К-де келтірілген, жану жылуы ∆HС деп белгіленеді. С-индекс ағылшын тіліндегі Combuction-жану дегенненалынады, стандартты жану жылуы ∆H0C,298 деп жазылады.
Реакцияның жылу эффектісі реакцияға түскен заттардың және реакция өнімдерінің жану жылулар қосындыларының айырымына тең.
∆H0r= 0c,298,түскен
зат-
0c,298,шыққан
зат.
0c,298,түскен
зат-
0c,298,шыққан
зат.
Мысалы, 2980С-де ацетиленнен бензолдыңтүзілу реакциясының жылу эффектісін табу керек, егер реакцияға қатысқан заттардың жану жылулары белгілі болса 3С2Н2(газ)=С6Н6(сұйық)
∆H0C,298(С2Н2)=-1299,63кДж/моль
∆H0C,298(С6Н6)=-3267,70кДж/моль∆H0r,298=3(-1299,63)-(-3267,70)=-631,19кДж/моль
в)реакцияға қатысатын заттардың түзілу жылуларының көмегімен реакцияның жылу эффектісін табу әдісі
Гесс заңынан шығатын тағы бір салдар бойынша реакцияның жылу эффектісі реакцияға қатысатын заттардың түзілу жылуларының алгебралық қосындысына тең. Заттың түзілу жылуы деп жай заттардан 1моль зат түзілгендегі жылуды аламыз. Анықтамалықтарда келтірілген заттардың түзілу жылулары стандартты жағдайларда алынады. Ол қысым 1атм болған жағдайда, стандартты түзілу жылуы∆H0ƒ,Т деп белгіленеді. ƒ-индексі ағылшын тіліндегі formation-түзілу дегеннен, егер температура 298К болып алынса, онда ∆H0ƒ,298деп жазылады.
∆H0r= 0ƒ,298,шыққан зат- 0ƒ,298,түзілген зат.
Мысалы, этанолды алу реакциясының жылу эффектісін табу керек болсын, реакцияға қатысқан заттардың стандартты түзілу жылулары белгілі болса, онда
С2Н4(газ)+Н2О(газ)=C2H5OH(газ)
∆H0ƒ,298(С2Н4)=52,28кДж/моль
∆H0ƒ,298(Н2О)=-241,84кДж/моль
∆H0ƒ,298(C2H5OH)=-235,3кДж/моль
∆H0r,298=-235,3-52,28-(-241,84)=-45,74кДж/моль.
