
Практикум_KX_2004
.pdfрушения и восстановления (релаксации) двойного ионного слоя мицеллы. Если скорости этих процессов равны, симметрия двойного ионного слоя успевает восстанавливаться. Если же скорость релаксации оказывается меньше скорости деформации двойного ионного слоя, наблюдается нарушение симметрии двойного ионного слоя и мицелла превращается в диполь.
Подходя к одному из электродов, частицы либо слипаются между собой, образуя видимые глазом агрегаты, либо прилипают к поверхности электрода. Так получают электрофоретические покрытия, находящие широкое практическое применение.
С помощью электрофореза можно определить знак заряда частиц дисперсной фазы. Частицы всегда перемещаются к электроду, который имеет противоположный знак заряда.
Смещение частиц дисперсной фазы относительно дисперсионной среды в электрическом поле происходит в пределах двойного ионного слоя по поверхности скольжения. Измерив линейную скорость движения частиц в золях или линейную скорость границы раствор − дисперсионная среда и зная градиент потенциала приложенного электрического поля, можно вычислить электрокинетический потенциал частиц ξ, В:
ξ = 4π η u , εc E
где η − вязкость дисперсионной среды, Па с; u − линейная скорость частиц, м/с;
E− напряженность электрического поля, В/м;
εc − диэлектрическая проницаемость среды, Ф/м.
Для разбавленных водных растворов солей принимают η Напряженность электрического поля E , В/м:
E = UL ,
(5.1)
= 1 10–3 Па с.
(5.2)
где U − разность потенциалов на электродах, В; L − расстояние между электродами, м.
61
Диэлектрическая проницаемость среды εc , Ф/м (в единицах СИ), связана с безразмерной (относительной) величиной диэлектрической проницаемости ε соотношением:
εc = 4π ε ε0 , |
(5.3) |
где ε0 = 8,85 10–12 Ф/м − электрическая константа.
Для водных растворов ε = 81.
Линейная скорость движения частицы (или границы золь − дисперси-
онная среда) u , м/с: |
|
|
u = h |
, |
(5.4) |
t |
|
|
где h − величина смещения, м;
t − время, в течение которого происходило смещение, с.
После преобразования уравнения (5.1) с помощью выражений (5.2), (5.3), (5.4) получают расчетную формулу
ξ= |
η h L |
|
|
|
. |
(5.5) |
|
ε ε t U |
|||
|
0 |
|
|
Для водных растворов ξ, В, можно рассчитать по уравнению:
|
10−3 |
h L |
6 |
|
h L |
|
|
||
ξ= |
|
|
=1,39 10 |
|
|
|
. |
(5.6) |
|
81 8,85 10−12 t U |
t U |
||||||||
|
|
|
|
|
|||||
Электроосмосом называют движение дисперсионной среды относительно неподвижной дисперсной фазы (пористого материала − диафрагмы) под влиянием внешней разности потенциалов.
Электроосмос можно наблюдать в U −образной трубке, наполненной дисперсионной средой; в нижней части трубки находится пористый материал, например кварцевый песок, являющийся дисперсной фазой.
Под действием внешнего электрического поля жидкость перетекает сквозь пористую диафрагму из одного в другое колено трубки, уровни жидкости смещаются на некоторую высоту h , м.
Причиной движения жидкости является наличие двойного электрическоо слоя (ДЭС) на границе между пористым материалом и жидкостью.
62

Под действием внешнего электрического поля ионы диффузного слоя, непрочно связанные с поверхностью, смещаются в сторону противоположно заряженного электрода. Ионы плотного слоя, относительно прочно связанные с поверхностью, практически остаются неподвижными. Ионы диффузного слоя, перемещаясь в капилляре, увлекают за собой жидкость (дисперсионную среду), заполняющую капилляр. Смещение жидкости, вызываемое движением ионов диффузного слоя, происходит не по границе твердое тело − жидкость, а по поверхности скольжения, расположенной на некотором расстоянии от твердой поверхности.
С помощью электроосмоса можно определить знак заряда твердой поверхности на границе с жидкостью, а также, измеряя скорость течения жидкости, вычислить потенциал на поверхности скольжения − электрокинетический потенциал ξ, В.
Из условия стандартного режима электроосмотического движения жидкости в плоском капилляре, когда можно пренебречь кривизной поверхности, Смолуховский получил уравнение, связывающее скорость течения жидкости и ξ–потенциал:
ξ= |
η u |
, |
(5.7) |
ε ε0 E |
где η − вязкость дисперсионной среды, Па с;
u − линейная скорость дисперсионной среды, м/с;
E− напряженность электрического поля, В/м;
ε− относительная диэлектрическая проницаемость;
ε0 =8,85 10−12 Ф/м.
Для практического применения более удобна формула, в которую входят величины, измеряемые непосредственно в опыте. Ее можно получить, если выразить линейную скорость u через объемную скорость q , м3/с, а E − через силу тока J , A:
|
|
u = |
|
q |
|
|
|
|
|||
|
|
|
|
, |
|
|
|
(5.8) |
|||
|
|
|
πr2 |
|
|
|
|||||
E = U |
= |
J R |
= |
|
J γ L |
= |
J |
. |
(5.9) |
||
L |
π r2 L |
π ω r2 |
|||||||||
L |
|
|
|
|
|
||||||
63
где r и L − радиус и длина капилляра, м;
J− сила тока, A;
γ− удельное сопротивление дисперсионной среды, Ом м;
ω − удельная электропроводность дисперсионной среды, Ом–1 м–1; U − разность потенциалов на концах капилляра, В.
После преобразований можно получить расчетную формулу:
ξ = |
η q ω |
. |
(5.10) |
|
|||
|
ε ε0 J |
|
|
Все величины, входящие в уравнение (5.10), измеряют экспериментально. В уравнении отсутствуют размеры капилляра, что позволяет измерить объемную скорость течения жидкости не через единичный капилляр (практически трудновыполнимо), а через систему капилляров, т.е. пористую диафрагму.
Входящие в уравнение (5.10) вязкость жидкости η, диэлектрическая проницаемость ε и удельная электропроводность ω измеряются для жидкости вне дисперсной системы. Это вносит некоторые ошибки в измеряемуювеличину ξ–потенциала, так как внутри диафрагмы в тонком слое около поверхности эти величины могут иметь другие значения.
Особенно велика ошибка в значении ξ–потенциала, если не учесть увеличение электропроводности жидкости в тонких капиллярах диафрагмы по сравнению с жидкостью в объеме раствора, связанное с повышенной концентрацией ионов вблизи поверхности (в пределах ДЭС).
Порядок выполнения работы по изучению электрофореза
Измеряют влияние концентрации электролита на электрофоретическую скорость движения границы золь – вода, причем измерения начинают со свежеприготовленного золя.
В две колбы наливают по 50 см3 золя, добавляют в каждую из них объем электролита V для получения указанной в задании концентрации.
Заданная концентрация электролита в золе C , кмоль/м3, определяется:
C = |
C0 V |
, |
(5.11) |
|
50 +V |
||||
|
|
|
||
64 |
|
|
||
где C0 − исходная концентрация электролита, кмоль/м3;
V − объем раствора электролита, см3, который необходимо добавить к 50 см3 золя для получения заданной концентрации.
Отсюда
V = |
50 C |
. |
(5.12) |
|
|
||||
|
C |
−C |
|
|
|
0 |
|
|
|
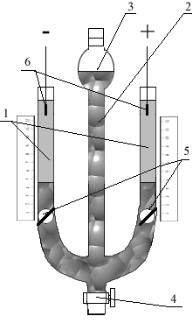
Добавление электролита к золю следует производить непосредственно перед измерением электрофоретической скорости, чтобы избежать коагуляции золя при длительном хранении. Измерение электрофоретической скорости проводят с помощью прибора Кена, изображенного на рис. 5.1.
Рисунок 5.1 − Схемa прибора Кена
Прибор представляет собой U −образную трубку, оба колена 1 которой градуированы (деления в единицах длины); к ней припаяна узкая стеклянная трубочка 2 с воронкой 3 и краном 4.
Прибор перед измерением тщательно промывают и ополаскивают дистиллированной водой. При закрытом кране 4 в воронку 3 наливают такое количество золя, чтобы вытеснить воздух из нижней части узкой трубки 2 и крана 4 и заполнить их золем. Открывают оба крана 5 и кран 4, золь вытесняет воздух, поднимаясь по U −образной трубке, причем выше кранов 5 золя быть не должно. Закрывают осторожно оба крана 5, а в оба колена U −образ-
65

ной трубки наливают по 15 см3 дистиллированной воды (боковой жидкости). При заполнении прибора необходимо следить за тем, чтобы в нем не оставалось пузырьков воздуха. Приготовленный таким образом прибор за-
крепляют на штативе.
В оба колена U −образной трубки помещают электроды, предварительно тщательно промытые водой, и закрепляют их так, чтобы нижние концы находились примерно на 3 – 4 см от верха градуированной трубки, после чего оба крана 5 открывают.
Затем осторожно приоткрывают кран 4, чтобы золь медленно натекал в U −образную трубку. При этом необходимо получить резкую границу окрашенный коллоидный раствор – вода, для чего золь следует вводить осторожно и медленно.
Когда граница золь – вода окажется на расстоянии 3 − 4 см от нижнего края электродов, а электроды будут находиться в воде, кран закрывают. Подключают электроды к источнику постоянного тока, отмечая при этом полюса в обоих коленах U −образной трубки.
Наблюдая за перемещением границы золь – вода, определяют знак заряда коллоидных частиц и записывают данные в табл. 5.1.
Таблица 5.1 − Экспериментальные данные по электрофорезу
C , кмoль/м3 |
L , м |
h , м |
ξ, В |
U ,B; t , мин; η, Па с; ε; ε0 = 8,85 10–12 Ф/м.
В отчете приводят способ получения коллоидного раствора, реакции образования трудно растворимого соединения и формулу мицеллы; при этом основываются на экспериментально установленном знаке заряда коллоидных частиц. По вычисленным значениям строят график зависимости ξ–потенци- ала от концентрации электролита C .
66
5.1. Задания к лабораторной работе 5
Определить зависимость ξ–потенциала золя от концентрации электролита. Знак – означает, что частица движется к аноду, а знак +, что частица движется к катоду.
1. Золь AgJ, электролит KNO3, T = 293 К |
|
|
|
|||||
C 105, кмoль/м3 |
|
L 102, м |
|
h 102, м |
|
|
ξ 103, B |
|
0 |
|
30 |
|
|
2,9 |
|
|
|
0,2 |
|
32 |
|
|
1,75 |
|
|
|
0,5 |
|
35 |
|
|
1,3 |
|
|
|
1,0 |
|
33 |
|
|
0,75 |
|
|
|
1,5 |
|
31 |
|
|
0,5 |
|
|
|
2,0 |
|
34 |
|
|
0,4 |
|
|
|
U = 120 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 |
= 8,85 10–12 Ф/м. |
||
2. Золь AgJ, электролит AgNO3, T = 293 К |
|
|
|
|||||
|
|
|
|
|
|
|
||
C 103, кмoль/м3 |
|
L 102, м |
|
h 102, м |
|
|
ξ 103, B |
|
0 |
|
30 |
|
|
5,3 |
|
|
|
15 |
|
32 |
|
|
5,6 |
|
|
|
25 |
|
35 |
|
|
5,0 |
|
|
|
50 |
|
33 |
|
|
5,1 |
|
|
|
75 |
|
31 |
|
|
4,7 |
|
|
|
100 |
|
34 |
|
|
2,1 |
|
|
|
U = 110 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 |
= 8,85 10–12 Ф/м. |
||
3. Золь AgJ, электролит KJ, T = 293 К |
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
C 103, кмoль/м3 |
|
L 102, м |
|
h 102, м |
|
|
ξ 103, B |
|
0 |
|
30 |
|
|
5,1 |
|
|
|
15 |
|
32 |
|
|
5,6 |
|
|
|
25 |
|
35 |
|
|
5,1 |
|
|
|
50 |
|
33 |
|
|
3,3 |
|
|
|
75 |
|
31 |
|
|
1,6 |
|
|
|
100 |
|
34 |
|
|
1,1 |
|
|
|
U = 115 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 |
= 8,85 10–12 Ф/м. |
||
|
67 |
|
|
|
|
|
||

4. Золь AgJ, электролит La(NO3)3, T = 293 К |
|
|
||||
|
|
|
|
|
ξ 103, B |
|
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
||
0 |
|
30 |
|
6,3 |
|
|
|
|
|
|
|
|
|
15 |
|
32 |
|
2,9 |
|
|
|
|
|
|
|
|
|
25 |
|
35 |
|
1,4 |
|
|
|
|
|
|
|
|
|
50 |
|
33 |
|
0,6 |
|
|
|
|
|
|
|
|
|
75 |
|
31 |
|
0,4 |
|
|
|
|
|
|
|
|
|
100 |
|
34 |
|
0,2 |
|
|
|
|
|
|
|
|
|
U = 125 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 = 8,85 10–12 Ф/м. |
|
5. Золь AgJ, электролит K3[Fe(CN)6], T = 293 К |
|
|
||||
|
|
|
|
|
ξ 103, B |
|
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
||
0 |
|
30 |
|
5,8 |
|
|
|
|
|
|
|
|
|
15 |
|
32 |
|
1,4 |
|
|
|
|
|
|
|
|
|
25 |
|
35 |
|
–1,2 |
|
|
|
|
|
|
|
|
|
50 |
|
33 |
|
–2,4 |
|
|
|
|
|
|
|
|
|
75 |
|
31 |
|
–2,3 |
|
|
|
|
|
|
|
|
|
100 |
|
34 |
|
–1,0 |
|
|
|
|
|
|
|
|
|
U = 115 B; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 = 8,85 10–12 Ф/м. |
|
6. Золь AgBr, электролит K4[Fe(CN)6], T = 293 К |
|
|
||||
|
|
|
|
|
ξ 103, B |
|
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
||
0 |
|
34 |
|
3,9 |
|
|
|
|
|
|
|
|
|
5 |
|
35 |
|
0,7 |
|
|
|
|
|
|
|
|
|
15 |
|
32 |
|
–1,7 |
|
|
|
|
|
|
|
|
|
25 |
|
33 |
|
–2,4 |
|
|
|
|
|
|
|
|
|
35 |
|
31 |
|
–2,1 |
|
|
|
|
|
|
|
|
|
50 |
|
30 |
|
–0,9 |
|
|
|
|
|
|
|
|
|
U = 120 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 = 8,85 10–12 Ф/м. |
|
68
7. Золь AgBr, электролит K2SO4, T = 293 К |
|
|
|
||||
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
|
ξ 103, B |
|
0 |
|
34 |
|
3,8 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
35 |
|
2,1 |
|
|
|
|
|
|
|
|
|
|
|
15 |
|
32 |
|
1,1 |
|
|
|
|
|
|
|
|
|
|
|
25 |
|
33 |
|
0,6 |
|
|
|
|
|
|
|
|
|
|
|
35 |
|
31 |
|
0,3 |
|
|
|
|
|
|
|
|
|
|
|
50 |
|
30 |
|
0,2 |
|
|
|
|
|
|
|
|
|
|
|
U = 117 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 |
= 8,85 10–12 Ф/м. |
|
8. Золь AgBr, электролит KJ, T = 293 К |
|
|
|
|
|||
|
|
|
|
|
|
|
|
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
|
ξ 103, B |
|
0 |
|
34 |
|
4,1 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
35 |
|
4,8 |
|
|
|
|
|
|
|
|
|
|
|
15 |
|
32 |
|
5,1 |
|
|
|
|
|
|
|
|
|
|
|
25 |
|
33 |
|
3,0 |
|
|
|
|
|
|
|
|
|
|
|
35 |
|
31 |
|
1,4 |
|
|
|
|
|
|
|
|
|
|
|
50 |
|
30 |
|
1,0 |
|
|
|
|
|
|
|
|
|
|
|
U = 127 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; |
ε0 |
= 8,85 10–12 Ф/м. |
|
9. Золь AgBr, электролит AgNO3, T = 293 К |
|
|
|
||||
|
|
|
|
|
|
|
|
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
|
ξ 103, B |
|
0 |
|
34 |
|
4,1 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
35 |
|
4,7 |
|
|
|
|
|
|
|
|
|
|
|
15 |
|
32 |
|
5,5 |
|
|
|
|
|
|
|
|
|
|
|
25 |
|
33 |
|
4,8 |
|
|
|
|
|
|
|
|
|
|
|
35 |
|
31 |
|
3,8 |
|
|
|
|
|
|
|
|
|
|
|
50 |
|
30 |
|
1,6 |
|
|
|
|
|
|
|
|
|
|
|
U = 130 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; |
ε = 81; ε0 |
|
= 8,85 10–12 Ф/м. |
|
69

10. Золь AgBr, электролит KNO3, T = 293 К |
|
ξ 103, B |
|||
C 103, кмoль/м3 |
|
L 102, м |
h 102, м |
|
|
0 |
|
34 |
3,8 |
|
|
5 |
|
35 |
2,9 |
|
|
15 |
|
32 |
2,5 |
|
|
25 |
|
33 |
1,9 |
|
|
35 |
|
31 |
1,7 |
|
|
50 |
|
30 |
1,5 |
|
|
U = 119 В; |
t |
= 60 мин; η = 1 10 |
–3 Па с; ε = 81; |
ε0 = 8,85 10–12 Ф/м. |
|
Порядок выполнения работы по изучению электроосмоса
Работа заключается в определении направления и скорости электроосмоса через пористые диафрагмы, изготовленные из различных веществ. Измерения проводят для нескольких значений концентрации электролита. По экспериментальным данным рассчитывают ξ–потенциал и строят график зависимости ξ–потенциала от концентрации С добавленного электролита.
Для определения скорости и направления электроосмотического потока в зависимости от вида исследуемого объекта применяют приборы различного типа. При исследовании порошковых диафрагм скорость электроосмоса можно измерить на приборе, изображенном на рис. 5.2.
Рисунок 5.2 − Схема для измерения электроосмоса:
1 − электроды; 2 − соединительные склянки с раствором медного купороса; 3 − агар-агаровые мостики; 4 − сосуд для электроосмоса; 5 − стакан с дисперсионной средой (фильтратом); 6 − пористая диафрагма из исследуемого материала; 7 − капилляр со шкалой; 8 − миллиамперметр; 9 − переключатель; 10 − источник тока
70
