Простые вещества
Все платиноиды являются редкими элементами, встречаются вместе и, как правило, в самородном состоянии. Важным источником этих металлов являются анодные шламы никелевого и медного производств. Разделение платиноидов является сложным технологическим процессом ввиду сходства химического поведения металлов и основывается на различии таких свойств однотипных соединений как растворимость и летучесть.
В чистом виде элементы являются тугоплавкими тяжелыми металлами, что указывает на прочность связей в кристаллах и значительной доле ковалентной составляющей.
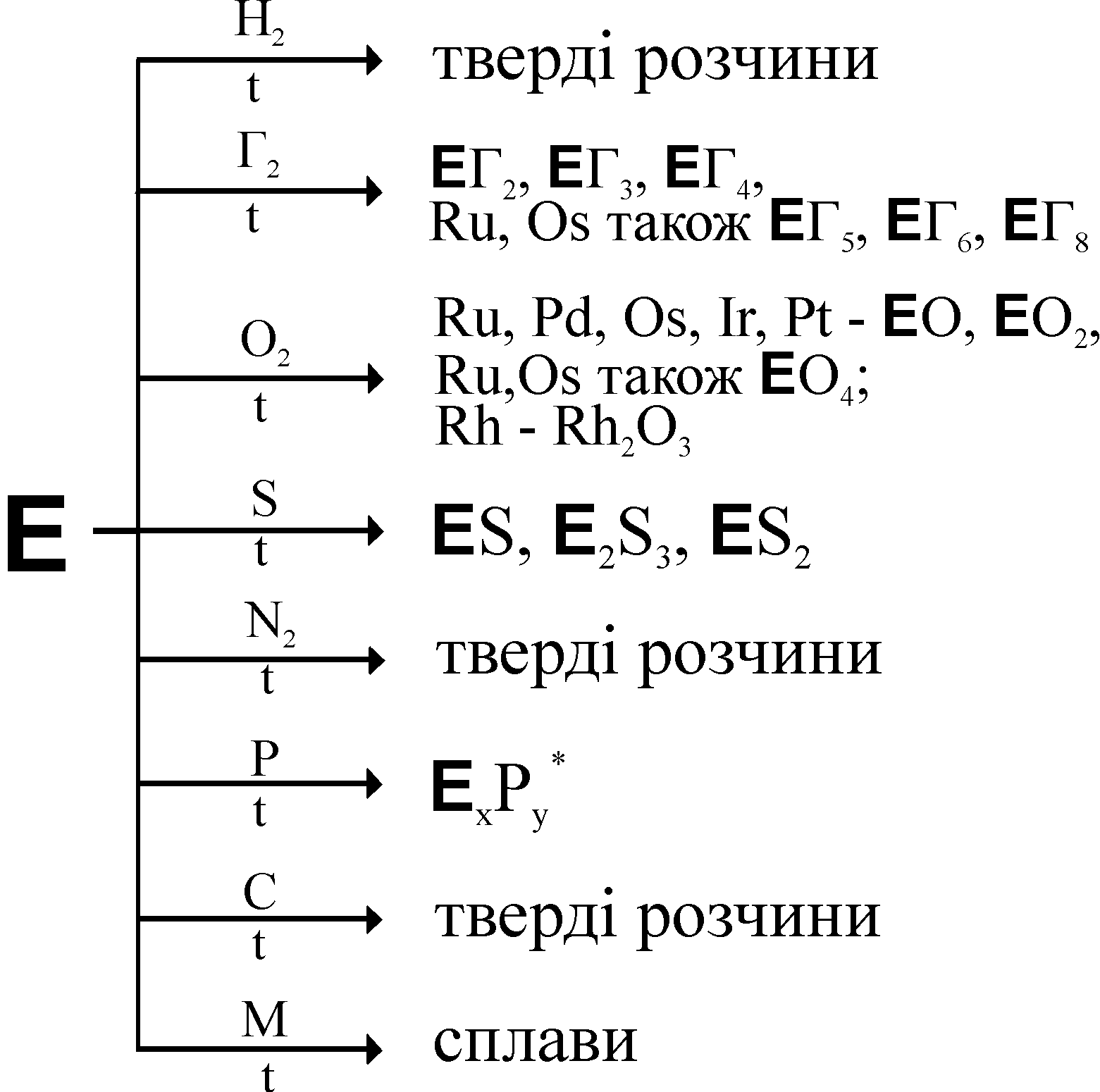
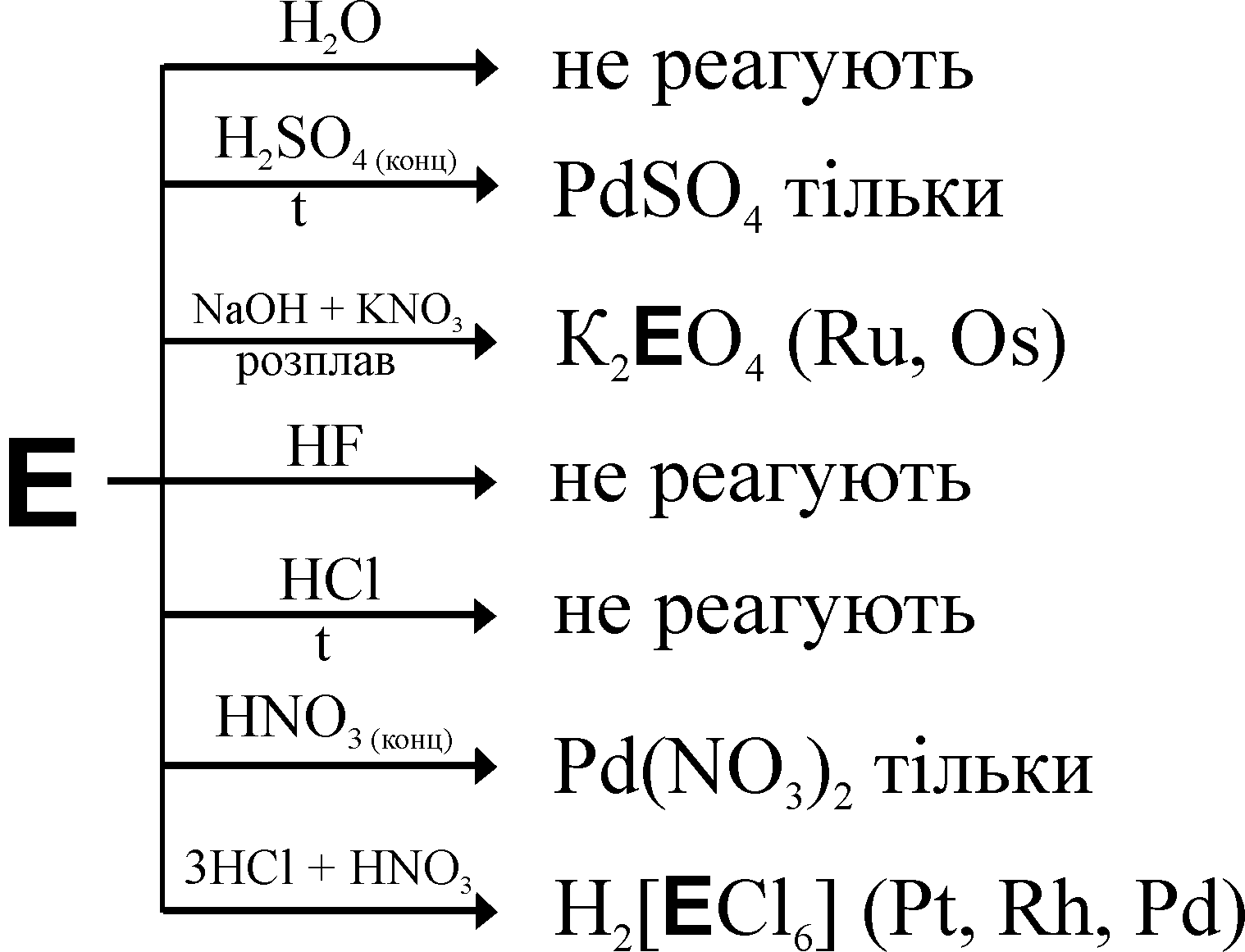
В химическом плане платиноиды являются благородными металлами – все они расположены гораздо правее водорода. Реакции металлов с основными реагентами приведены на следующих схемах:
|
|
|
|
реакции с простыми веществами |
реакции со сложными веществами |
В неокисляющих кислотах нерастворимы все платиноиды, в азотной кислоте растворяется только палладий, а в царской водке – платина:
Pd + 4HNO3(конц.) Pd(NO3)2 + 2NO2 + 2H2O
3Pt + 4HNO3 + 18HCl 3H2[PtCl6] + 4NO + 8H2O
Зато устойчивость к щелочам в присутствие окислителей у всех платиноидов невелика, особенно у Ru и Os:
Os + 3KClO + 2KOH(конц., гор.) + H2O = K2[OsO2(OH)4] + 3KCl
Все платиновые металлы растворяются в HCl в присутствии Cl2, сульфат родия может быть получен растворением порошка металла в концентрированной кислоте, либо сплавлением с гидросульфатами щелочных металлов:
2Rh + 12KHSO4 = 2K3[Rh(SO4)3] + 3SO2 + 6H2O + 3K2SO4 (700 °C)
Таким образом, лучшими растворителями для металлов являются:
– расплав щелочи + окислитель (NaClO, Na2O2) для Ru и Os;
– смесь HCl(конц.)+ NaClO3при 125 – 150°C для Rh и Ir;
– царская водка для Pd и Pt.
В отношении к кислороду прослеживается различие между диадами платиноидов. Ru и Os легко окисляются кислородом при нагревании, вторая диада окисляется кислородом при сильном нагревании, а палладий и платина кислородом практически не окисляются, т.к. их оксиды термически неустойчивы.
По отношению к остальным неметаллам платиноиды устойчивы при обычных температурах. При нагревании образуются галогениды и халькогениды платиноидов. Углерод не образует определенных химических соединений, но растворяется в платиноидах при высокой температуре, делая их хрупкими. Поэтому при работе с платиновой посудой при высокой температуре следует избегать контакта с веществами, выделяющими углерод при разложении (коптящее пламя горелки). Уникальной способностью поглощать большие количества водорода обладает палладий (до 900 объемов H2на один объем палладия), что используется для глубокой очистки водорода.
Мелкодисперсные платиноиды обладают высокой каталитической активностью.
Соединения платиноидов первого порядка
Вследствие явно выраженной склонности к комплексообразованию, химия простых соединений платиноидов бедна и не является характеристической.
Оксиды Ru и Os получаются прямым окислением порошков металлов, при этом Os дает сразу высший оксид, а Ru вначале окисляется до RuO2, а затем – до RuO4. Различие в свойствах RuO2и OsO2проявляется при нагревании: первый разлагается, а второй – диспропорционирует:
RuO2 = Ru + O2
2OsO2 = Os + OsO4
В целом ЭO2проявляют окислительные свойства:
2RuO2 + 8HCl(конц.) = 2RuCl3 + Cl2 + 4H2O
но как окислители диоксиды заметно уступают тетраоксидам:
OsO4 + KNO2(разб.) + 2KОН + Н2О = K2[OsO2(OH)4] + KNO3
По значению электрического сопротивления RuO2приближается к металлам, а по устойчивости к окислению превосходит их. Поэтому он является ценным анодным материалом при выделении O2и Cl2.
Высшие оксиды растворимы в воде, но
химически с нею не взаимодействуют.
RuO4и OsO4взаимодействуют
только со щелочами, но при этом ведут
себя по-разному. RuO4восстанавливается
до![]() ,
а OsO4увеличивает координационное
число без изменения степени окисления:
,
а OsO4увеличивает координационное
число без изменения степени окисления:
2RuO4 + 4NaOH = 2Na2RuO4 + O2 + 2H2O
OsO4 + 2KOH = K2[OsO4(OH)2]
Солеобразные соединения первого порядка вообще неизвестны для Ru(+8) и Os(+8); зато известны соли Ru(+6) и Os(+6), которые не имеют соответствующих оксидов и гидроксидов. Рутенаты(+6) и осматы(+6) получаются окислением металлов в расплавах щелочей:
Э + 2NaOH + 3NaNO3 Na2ЭO4 + H2O + 3NaNO2
Полученные соли можно окислить далее, при этом рутенаты(+6) переходят в рутенаты(+7), а осматы(+6) – в OsO4:
2Na2RuO4 + Cl2 2NaRuO4 + 2NaCl
Na2OsO4 + Cl2 OsO4 + 2NaCl
Окислением Rh и Ir кислородом при 600 °C получают Rh2O3и IrO2. Окислительные свойства первого из оксидов проявляются сильнее, чем восстановительные, тогда как IrO2проявляет сильные окислительные свойства:
Rh2O3 + Na[Sn(OH)3] + NaOH(конц.) + 3H2O = 2Rh(OH)2 + Na2[Sn(OH)6] + 4H2O,
Rh2O3 + 4NaOH(конц.) + 3NaClO = 2Na2RhO4 + 3NaCl + 2H2O.
IrO2 + H2 = Ir + H2O (500 °C)
Соответствующие гидроксиды проявляют амфотерный характер, но если первый из них имеет более основный характер, то второй – кислотный. Особенно хорошо протекает процесс растворения в HCl за счет комплексообразования:
Rh2O3 + 6HCl(конц.) = H3[RhCl6] + 3H2O
Rh2O3 + Li2O = 2LiRhO2 (900 °C)
IrO2 + 6HCl = H2[IrCl6] + 2H2O
Оксиды и гидроксиды родия и иридия в более высоких, чем +4, степенях окисления неизвестны.
Оксид палладия(+2) получается окислением металла к токе кислорода. Хотя он не растворяется в кислотах, соответствующий гидроксид легко с ними реагирует и имеет основной характер лишь со слабыми признаками амфотерности:
PdO + HBr(конц) = H2[PdBr4] + H2O
PdO + K2O = K2PdO2 (600 °C)
Оксиды платины(+2) и платины(+4) получаются косвенным путем и уже при получении (400 °C) разлагаются (420 °C) в значительной степени с выделением металла.
При взаимодействии растворов щелочей и галогенидов или нитратов платиновых металлов в осадок выпадают гидратированные оксиды, которые практически невозможно получить в чистом виде; кроме того, они легко переходят в коллоидное состояние:
IrCl4 + 4NaOH(разб) + (n – 2)H2O = IrO2↓·nH2O + 4NaCl
Поэтому данные соединения не имеют особого значения для химии платиноидов.
Известно много галогенидов платиноидов, особенно фторидов и хлоридов. Во всех галогенидах, кроме фторидов, реализуются степени окисления до +4 включительно, причем для этих соединений характерны реакции последовательного отщепления галогена при нагревании с понижением степени окисления металла вплоть до 0. Среди фторидов известны ЭF3, ЭF4, ЭF5, ЭF6(для палладия – PdF2, PdF3и PdF4), а также RuF8и OsF8. Одним из сильнейших известных окислителей является PtF6, способный окислять молекулярный кислород и тяжелые благородные газы:
O2 + PtF6 = O2[PtF6]
PdCl2обладает ценным качеством: легко восстанавливается такими восстановителями как этен или метановая кислота, а также используется как очень чувствительный индикатор на CO:
PdCl2 + HCOOH = Pd↓(чернь) + 2HCl + CO2 (50–70 °C)
PdCl2 + CO + H2O Pd + CO2 + 2HCl
Хлориды платиноидов имеют практическое значение для технологии этих металлов из-за относительной легкости получения и способности образовывать растворимые комплексы в растворе HCl:
PdCl2 + 2HCl(конц) = H2[PdCl4]
|
Металл |
Важнейший хлорид |
Температура, °C |
ΔH, кДж/моль |
|
Ru |
RuCl3 |
500 – 850 |
–266 (–196) |
|
Os |
OsCl4 |
600 |
–255 (–158) |
|
Rh |
RhCl3 |
400 – 600 |
–229 (–167) |
|
Ir |
IrCl3 |
600 |
–263 (–199) |
|
Pd |
PdCl2 |
300 |
–163 |
|
Pt |
PtCl2 PtCl4 |
500 300 |
–106 (–93) –230 (–164) |
В отличие от кислорода, сера относительно легко реагирует с платиноидами, образуя соединения ЭS и ЭS2. Если первая диада платиноидов легко окисляется кислородом, а последняя – трудно, то с серой все обстоит наоборот. Кроме прямого синтеза возможно осаждение сульфидов из растворов даже комплексных соединений из-за низкой растворимости всех сульфидов:
(NH4)2[PtCl6] + 2H2S(насыщ) = PtS2↓ + 4HCl + 2NH4Cl
В отличие от остальных платиноидов, иридий не осаждается из нитратных (ІІІ) комплексов в виде сульфида, что используется при отделении его от Rh, Pt и Pd:
2Na3[Rh(NO2)6] + 3Na2S = Rh2S3↓ + 12NaNO2,
Na3[Ir(NO2)6] + 3Na2S ≠
Сульфиды нерастворимы в кислотах-неокислителях, но растворяются в азотной кислоте или смеси HNO3(конц.)+ HCl(конц.). Некоторые из сульфидов проявляют полупроводниковые свойства.