
- •Сборник задач по органической химии
- •Оглавление
- •Введение
- •Углеводороды
- •Гомологический ряд метана
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •1.2. Непредельные углеводороды
- •1.2.1. Алкены. Диены
- •Номенклатура
- •Изомерия
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •1 Моль → 1 моль → 1 моль
- •Упражнения и задачи для самостоятельной работы
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •1.3. Ароматические углеводороды
- •Изомерия
- •Получение
- •Химические свойства
- •Реакции электрофильного замещения
- •Химические свойства гомологов бензола
- •Химические свойства
- •Упражнения и задачи для самостоятельной работы
- •2. Кислородосодержащие органические соединения
- •2.1. Спирты
- •Одноатомные спирты
- •Номенклатура
- •Получение
- •Химические свойства спиртов
- •II. Реакции с разрывом с−о связи.
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •2.2. Альдегиды и кетоны
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •64 Г СаС2 – 60 г сн3соон
- •1 Моль Ag2o − 2 моль Ag
- •Упражнения и задачи для самостоятельной работы
- •2.3. Карбоновые кислоты и их производные
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •2.3.1. Сложные эфиры карбоновых кислот
- •Физические свойства
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •3. Азотсодержащие органические соединения
- •Нитросоединения
- •Строение
- •Номенклатура
- •Получение
- •Химические свойства
- •3.2. Амины
- •Изомерия
- •Номенклатура
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •4. Аминокислоты. Пептиды. Белки
- •Получение
- •Важнейшие аминокислоты
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •Углеводы
- •Глюкоза
- •Химические свойства
- •Химические свойства
- •Полисахариды
- •Химические свойства
- •Целлюлоза (клетчатка)
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •Литература
Получение
Действием спиртового раствора щёлочи на дигалогеналканы
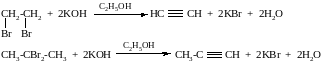
2. При действии галогеналканов на соли ацетиленовых углеводородов
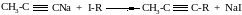
3. Высокотемпературный крекинг метана
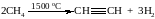
4. Гидролиз карбида кальция
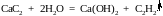
Химические свойства
Химические свойства алкинов во многом аналогичны свойствам других непредельных соединений.
1. Галогенирование (алкины обесцвечивают бромную воду)
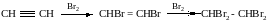
2. Гидрогалогенирование
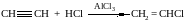
В случае избытка галогеноводорода
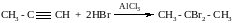
3. Гидратация
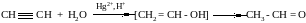
4. Алкины обладают кислотными свойствами
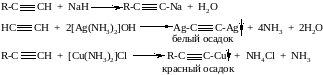
5. Окисление перманганатом калия с разрывом тройной связи
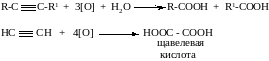
6. Восстановление
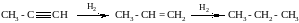
Полимеризация ацетилена
Т

 римеризация
на активированном угле при 500 оС
с получением бензола:
римеризация
на активированном угле при 500 оС
с получением бензола:
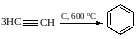
Димеризация с получением винилацетилена:
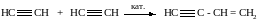
Катализатор: водный раствор CuCl / NH4Cl.
Примеры решения типовых задач
Пример № 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
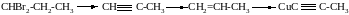 Укажите
условия протекания реакций.
Укажите
условия протекания реакций.
Решение: 1. Действуя спиртовым раствором щёлочи на дибромпроизводное алкана, получаем пропин:
CHBr2 – CH2 – CH3 + 2KOH CHC – CH3 + 2KBr + 2H2O
2. Пропин гидрируется до пропилена (катализатор – железо):
СН
С – СН3 + Н2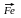 СН = СН – СН3
СН = СН – СН3
3. При взаимодействии пропина с аммиачным раствором оксида меди (I) получаем метилацетиленид меди (I):
СН С – СН3 + Cu2O 2CuC С – СН3 + H2O
Пример № 2. Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение:
1. Общая формула алкина СnH2n−2.
2. Плотность d – это масса 1 литра газа при нормальных условиях. Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность d) ∙ (молярный объём Vm) = 2,41 г/л ∙ 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
Пример №3. Технический карбид кальция массой 5 г обработали избытком воды и получили ацетилен, который с избытком аммиачного раствора оксида серебра образует ацетиленид серебра массой 15,6 г. Определите массовую долю CaC2 в техническом карбиде.
Решение: 1. Вычисляем количество вещества образовавшегося ацетиленида серебра Ag2C2:
n(Ag2C2)
=
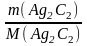 ;
n(Ag2C2)
=
;
n(Ag2C2)
=
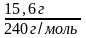 = 0,065 моль.
= 0,065 моль.
2. Составляем уравнения реакций между карбидом кальция и водой, ацетиленом и аммиачным раствором оксида серебра:
СаС2 + 2Н2О Са(ОН)2 + С2Н2
С2Н2 + Ag2О Ag2С2 + Н2О
n(СаС2) = n(Ag2С2); n(СаС2) = 0,065 моль.
3. Рассчитываем массу СаС2 в образце технического карбида:
m (СаС2) = n (СаС2) M (СаС2)
m (СаС2) = 0,065 моль 64 г/моль = 4,16 г
4. Массовая доля СаС2 в техническом карбиде равна:
(СаС2) =
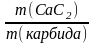 ;
(СаС2) =
;
(СаС2) =
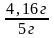 = 0,832 или 83,2 %.
= 0,832 или 83,2 %.
Пример №4. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов, и назовите их.
Решение:
Тройная связь в главной цепи может находиться в положениях 1 и 2. В первом случае возможны четыре структурных изомера (две группы −СН3 в положениях 3,3; 3,4; 4,4 или одна группа −С2Н5 в положении 3):
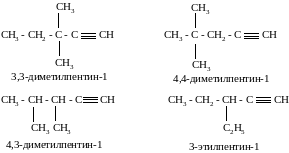
Во втором случае возможен единственный изомер, когда две метильные группы находятся в положении 4:
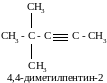
Ответ: 5 изомеров.
Пример № 5. При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси.
Решение: Ацетилен поглощается бромной водой:
НC СH + 2Вr2 → НСВr2 - СНВr2
1,3 г − это масса ацетилена; n(C2H2) = 1,3/26 = 0,05 моль. При сгорании этого количества ацетилена по уравнению
2С2Н2 + 5О2 = 4СО2 + 2Н2О
выделилось 2 ∙ 0,05 = 0,1 моль СО2. Общее количество СО2 равно
14/22,4 = 0,625 моль. При сгорании пропана по уравнению
С3Н8 + 5О2 = ЗСO2 + 4Н2О выделилось 0,625 − 0,1 = 0,525 моль СО2, при этом в реакцию вступило
0,525/3 = 0,175 моль С3Н8 массой 0,175 ∙44 = 7,7 г. Общая масса смеси углеводородов равна 1,3+7,7 = 9,0 г, а массовая доля пропана составляет: (С3Н8) =7,7/9,0 = 0,856, или 85,6 %.
Ответ: 85,6 % пропана.
Пример 6. Дихлоралкан, в котором атомы хлора находятся у соседних атомов углерода, обработали избытком спиртового раствора щёлочи. Масса выделившегося газа оказалась в 2,825 раза меньше массы исходного дихлоралкана. Установите строение исходного соединения и продукта реакции.
Решение: При обработке дихлоралкана избытком спиртового раствора щёлочи отщепляются две молекулы хлороводорода и образуется алкин:
CnH2nCl2 + 2KOHспирт → CnH2n-2 + 2KCl + 2Н2О. Согласно уравнению реакции, из 1 моль СnН2nСl2 массой (14n + 71) г выделяется 1 моль СnН2n-2 массой (14n − 2) г. По условию, (14n − 2) ∙ 2,825 = 14n + 71,
откуда n = 3. Искомый алкин − пропин, С3Н6, он образуется из 1,2-дихлор-
пропана.
Ответ: 1,2-дихлорпропан; пропин.
Пример №7. Какой объём воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена?
Решение:
(1) CH4 + 2O2 = CO2 + 2H2O
на 1 моль CH4 требуется 2 моль O2
(2) 2C2H2 + 5O2 = 4CO2 + 2H2O
на 2 моль C2H2 требуется 5 моль O2
Объём кислорода, который пойдёт на сжигание заданного объёма метана V1(O2) и ацетилена V2(O2), составит: V1(O2) = 2V(CH4) = 2 ∙ 5 = 10 л; V2(O2) = 5/2 V(C2H2) = 5/2 ∙ 15 = 37,5 л; V(O2) = V1(O2) + V2(O2) = 10 л + 37,5 л = 47,5 л, отсюда рассчитаем объём воздуха на сжигание (содержание кислорода в воздухе принимаем равным 21 % по объёму): V(воздуха) = V(O2) : 0,21 = 47,5 л : 0,21 = 226 л.
Ответ: V(воздуха) = 226 л.
