
- •Сборник задач по органической химии
- •Оглавление
- •Введение
- •Углеводороды
- •Гомологический ряд метана
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •1.2. Непредельные углеводороды
- •1.2.1. Алкены. Диены
- •Номенклатура
- •Изомерия
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •1 Моль → 1 моль → 1 моль
- •Упражнения и задачи для самостоятельной работы
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •1.3. Ароматические углеводороды
- •Изомерия
- •Получение
- •Химические свойства
- •Реакции электрофильного замещения
- •Химические свойства гомологов бензола
- •Химические свойства
- •Упражнения и задачи для самостоятельной работы
- •2. Кислородосодержащие органические соединения
- •2.1. Спирты
- •Одноатомные спирты
- •Номенклатура
- •Получение
- •Химические свойства спиртов
- •II. Реакции с разрывом с−о связи.
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •2.2. Альдегиды и кетоны
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •64 Г СаС2 – 60 г сн3соон
- •1 Моль Ag2o − 2 моль Ag
- •Упражнения и задачи для самостоятельной работы
- •2.3. Карбоновые кислоты и их производные
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •2.3.1. Сложные эфиры карбоновых кислот
- •Физические свойства
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •3. Азотсодержащие органические соединения
- •Нитросоединения
- •Строение
- •Номенклатура
- •Получение
- •Химические свойства
- •3.2. Амины
- •Изомерия
- •Номенклатура
- •Получение
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •4. Аминокислоты. Пептиды. Белки
- •Получение
- •Важнейшие аминокислоты
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •Углеводы
- •Глюкоза
- •Химические свойства
- •Химические свойства
- •Полисахариды
- •Химические свойства
- •Целлюлоза (клетчатка)
- •Химические свойства
- •Примеры решения типовых задач
- •Упражнения и задачи для самостоятельной работы
- •Литература
Примеры решения типовых задач
Пример № 1. Рассчитайте объём уксусной эссенции (плотность 1,07 г/см), которую надо разбавить водой для приготовления столового уксуса объёмом 500 мл (плотность 1,007 г/мл). Массовая доля уксусной кислоты в уксусной эссенции равна 80 %, а в уксусе – 6 %.
Решение.
Определяем массу раствора уксуса, который надо приготовить:
m2 = V22; m2 = 500 1,007 = 503,5 г.
Вычисляем массу уксусной кислоты, которая содержится в уксусе:
m(СН3СООН)
=
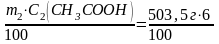 = 30,21 г.
= 30,21 г.
Рассчитываем массу уксусной эссенции, которая содержит уксусную кислоту массой 30,21 г:
m1=
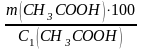 ; m1 =
; m1 =
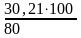 = 37,76 г.
= 37,76 г.
Находим объём уксусной эссенции, которую надо разбавить для приготовления уксуса:
V1
=
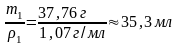
Ответ: 35,5 мл.
Пример № 2. На нейтрализацию предельной одноосновной кислоты массой 7,4 г затрачен раствор с массовой долей гидроксида калия 40 % объёмом
10 мл и плотностью 1,4 г/мл. Определите формулу кислоты.
Решение:
1. Вычисляем массу раствора гидроксида калия, затраченного на нейтрализацию кислоты:
m = V; m = 10 г 1,4 г/мл = 14 г
2. Определяем массу гидроксида калия, содержащегося в растворе:
m(КОН)
=
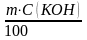 ;
m(КОН) =
;
m(КОН) =

3. Количество вещества КОН составляет:
n(КОН)
=
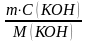 ;
n(КОН) =
;
n(КОН) =
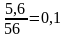 моль
моль
4. Молярную массу кислоты А можно представить в следующем виде:
М(А) = (х + 1)М(С) + (2х + 1 + 1)М(Н) + 2М(О);
М(А) = [(х + 1)12 + (2х + 2) 1 + 2 16] г/моль = (14х + 46) г/моль
5. Рассчитываем количество вещества кислоты, взятой для реакции:
n(А)
=
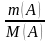 ;
n(А) =
;
n(А) =
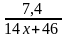 ;
;
6. Составляем уравнение реакции нейтрализации кислоты:
СхН2х+1СООН + КОН СхН2х+1СООК + Н2О
Из этого уравнения реакции следует, что n(КОН) = n(А), отсюда:
0,1 = ;
Решая это уравнение, находим, что х = 2.
Таким образом, формула кислоты − С2Н5СООН (пропионовая кислота).
Пример № 3. Вычислите массу уксусной кислоты, которую можно получить из 44,8 л (н.у.) ацетилена, если потери на каждой стадии получения составляют в среднем 20 %.
Решение:
C2H2 + H2O → CH3CHO → CH3COOH
1моль 1 моль 1 моль
n(CH3COOH)теор = n(C2H2) = V(C2H2) / VM = 44,8 л : 22,4 л/моль = 2 моль n(CH3COOH)практ = n(CH3COOH)теор∙h1∙∙h2 = 2 моль∙ 0,8 ∙ 0,8 = 1,28 моль Масса уксусной кислоты с учетом всех потерь составит: m(CH3COOH) = n(CH3COOH)практ∙ M(CH3COOH) = 1,28 моль∙ 60 г/моль = 76,8 г
Ответ: m(CH3COOH) = 76,8 г.
Пример № 4. При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Решение:
1. CnH2n+1COOH + NaHCO3 → CnH2n+1COONa + H2O + CO2
2. Найдем количество вещества СО2
n(CO2) = V/Vm = 5,6л : 22,4 л/моль = 0,25 моль
3. n(CO2) = n(кислоты) = 0,25 моль (из уравнения видно это соотношение 1:1), тогда молярная масса кислоты равна:
M(к-ты) = m/n = 25,5г : 0,25 моль = 102г/моль
М(к-ты) = 12n+2n+1+12+16+16 (из общей формулы),
М = Ar(C)∙ n + Ar(H)∙ n + Ar(O)∙ n = 12∙n + 1∙(2n+1)+ 12+16+16+1)
М(к-ты) = 12n +2n +46 = 102; n = 4; Формула кислоты С4Н9СООН.
