
- •Содержание
- •Введение
- •1 Химическая термодинамика и химическое равновесие
- •1.1 Первое начало термодинамики
- •1.2 Расчет тепловых эффектов химических реакций
- •Второе начало термодинамики
- •1.4 Расчет изменения энтропии и энергии Гиббса в химических процессах
- •1.5 Термодинамический анализ возможности протекания химического процесса
- •1.6 Химическое равновесие
- •1.7 Расчет степени превращения исходных веществ, выхода продукта и равновесного состава химической реакции
- •1.8 Константы равновесия гетерогенных реакций
- •1.9 Многовариантное задание №1 «Расчет степени превращения, равновесного состава и выхода продукта химической реакции и выбор оптимальных условий проведения процесса»
- •1.10 Многовариантное задание №2 «Расчет равновесных парциальных давлений гетерогенной химической реакции»
- •1.11 Контрольные вопросы
- •2 Фазовые равновесия
- •2.1 Однокомпонентные системы
- •2.1.1 Многовариантное задание №3 «Анализ фазового равновесия жидкость – пар в однокомпонентной системе»
- •2.2 Двухкомпонентные системы
- •2.2.1 Идеальные и неидеальные растворы
- •2.2.1.1 Многовариантное задание №4 «Определение активности и коэффициента активности растворителя в растворе»
- •2.2.1.2 Многовариантное задание № 5 «Коллигативные свойства растворов»
- •2.2.2 Диаграммы состав - свойство для равновесия жидкость - пар
- •2.2.2.1 Многовариантное задание № 6 «Анализ фазовых равновесий жидкость – пар в двухкомпонентной системе»
- •2.2.3 Диаграммы плавкости
- •2.2.3.1 Типы диаграмм плавкости. Основные понятия
- •2.2.3.2 Диаграмма плавкости, компоненты которой полностью не растворимы друг в друге и в жидком и в твердом состояниях
- •2.2.3.3 Диаграмма плавкости, компоненты которой неограниченно растворимы друг в друге в жидком и в твердом состояниях
- •2.2.3.4 Диаграмма плавкости, компоненты которой неограниченно растворимы в жидком и полностью не растворимы друг в друге в твердом состояниях
- •2.2.3.5 Диаграмма плавкости, компоненты которой ограниченно растворимы друг в друге в твердом состоянии
- •2.2.3.6 Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся без разложения
- •2.2.3.7 Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся с разложением
- •2.2.3.8 Примеры анализа диаграмм состояния
- •2.2.3.9 Многовариантное задание № 7 «Анализ диаграмм плавкости»
- •2.3 Контрольные вопросы
- •2.4 Вопросы к теоретическому коллоквиуму по теме «Фазовые равновесия»
- •3 Электрохимические системы
- •3.1 Гальванические элементы
- •3.1.1 Классификация электродов
- •3.1.2 Классификация гальванических элементов
- •3.1.3 Определение термодинамических параметров реакции, протекающей в гальваническом элементе
- •3.1.4 Многовариантное задание №8 «Гальванические элементы»
- •3.2 Электрическая проводимость растворов электролитов
- •3.2.1 Многовариантное задание № 9 «Электрическая проводимость растворов электролитов»
- •3.3 Контрольные вопросы
- •4 Методы определения строения вещества
- •4.1 Электрические свойства молекул
- •4.1.1 Многовариантное задание № 10 «Электрические свойства молекул»
- •4.1.2. Контрольные вопросы
- •4.2 Оптические методы изучения строения молекул. Молекулярные спектры
- •4.2.1 Общая характеристика молекулярных спектров
- •4.2.2 Закон Бугера-Ламберта-Бера
- •4.2.3 Энергия вращения двухатомной молекулы в приближении жесткого ротатора. Вращательные спектры молекул и их применение для определения молекулярных характеристик
- •4.2.4 Многовариантное задание № 11 «Вращательные спектры двухатомных молекул»
- •4.2.5 Колебательные спектры двухатомных молекул
- •4.2.6 Многовариантное задание №12 «Колебательные спектры двухатомных молекул»
- •4.3 Контрольные вопросы
- •5 Элементы статистической термодинамики
- •5.1 Многовариантное задание № 13 «Расчет теплоемкости идеального газа»
- •5.2 Контрольные вопросы
- •6 Химическая кинетика
- •6.1 Многовариантное задание № 14 «Расчет кинетических параметров гомогенных химических реакций»
- •6.2 Многовариантное задание № 15 «Влияние температуры на скорость химической реакции»
- •6.3 Контрольные вопросы
- •Литература основная
- •Дополнительная
- •Приложение (рекомендованное)
- •Предметный указатель
- •Физическая химия
- •190013, Санкт-Петербург, Московский пр., 26
1.2 Расчет тепловых эффектов химических реакций
В
стандартных условиях тепловой эффект
химической реакции
 может
быть рассчитан по справочным значениям
теплот образования
:
может
быть рассчитан по справочным значениям
теплот образования
:
|
(1.15) |
здесь
и далее индексы i
относятся к исходным веществам или
реагентам, а индексы j
–
к конечным веществам или продуктам
реакции;
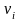 и
и
 – стехиометрические коэффициенты в
уравнении реакции для исходных веществ
и продуктов реакции, соответственно.
– стехиометрические коэффициенты в
уравнении реакции для исходных веществ
и продуктов реакции, соответственно.
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при стандартных условиях.
Решение: Для расчетов воспользуемся справочными данными по стандартным теплотам образования, участвующих в реакции веществ (см. табл. 44 на стр.72 справочника [2]).
Реакция |
СО(Г.) |
+ 2 Н2 (г.) |
= СН3ОН(г.) |
Теплоты образования , кДж/моль |
– 110,53 |
0 |
– 201,00 |
Тепловой эффект реакции синтеза метанола в стандартных условиях по первому следствию из закона Гесса (уравнение 1.15) равен:

При расчете тепловых эффектов химических реакции нужно учитывать, что тепловой эффект зависит от агрегатного состояния реагентов и от вида записи химического уравнения реакции:
Реакция |
Тепловой эффект в стандартных условиях |
СО(г.) + 2 Н2 (г.) = СН3ОН(г.) |
= – 90,47 кДж |
СО(г.) + 2 Н2 (г.) = СН3ОН(ж.) |
= – 128,04 кДж |
0,5 СО(г.) + Н2 (г.) = 0.5 СН3ОН(ж.) |
= – 64,02 кДж
|
По второму следствию из закона Гесса тепловой эффект можно рассчитать, используя теплоты сгорания ΔcH, как разность сумм теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов):
|
(1.16) |
Большинство химических реакций в химико-технологических системах ведут при повышенных температурах, чтобы повысить скорость реакций и, следовательно, повысить производительность системы. Для того чтобы рассчитать тепловой эффект химической реакции при любой температуре надо знать вид зависимости теплового эффекта от температуры ΔrH = f(T). Эта зависимость выражается законом Кирхгофа. В дифференциальной форме закон Кирхгофа имеет вид:
|
(1.17) |
где ΔrCp – характеризует изменение изобарной теплоемкости системы в результате протекания химической реакции и называется температурным коэффициентом теплового эффекта реакции.
Из дифференциального уравнения Кирхгоффа следует, что зависимость теплового эффекта от температуры определяется знаком ΔrCp, т.е. зависит от того, что больше, суммарная теплоемкость исходных веществ или суммарная теплоемкость продуктов реакции. Проанализируем дифференциальное уравнение Кирхгофа.
1.
Если температурный коэффициент ΔrC
p
>
0, то производная
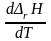 >
0 и функция
>
0 и функция
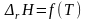 возрастающая. Следовательно, тепловой
эффект реакции с ростом температуры
увеличивается.
возрастающая. Следовательно, тепловой
эффект реакции с ростом температуры
увеличивается.
2. Если температурный коэффициент ΔrCp < 0, то производная < 0 и функция убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
3.
Если температурный коэффициент ΔrCp
= 0, то производная
= 0 и
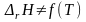 .
Следовательно, тепловой эффект реакции
не зависит от температуры. Этот случай
на практике не встречается.
.
Следовательно, тепловой эффект реакции
не зависит от температуры. Этот случай
на практике не встречается.
Дифференциальные уравнения удобны для анализа, но неудобны для расчетов. Чтобы получить уравнение для расчета теплового эффекта химической реакции, проинтегрируем дифференциальное уравнение Кирхгофа, разделив переменные:



Теплоемкости
веществ зависят от температуры,
следовательно, и
 .
Однако, в области обычно используемых
в химико-технологических процессах
температурах эта зависимость не
значительна. Для практических целей
пользуются средними теплоемкостями
веществ в интервале температур от 298 К
до заданной температуры
.
Однако, в области обычно используемых
в химико-технологических процессах
температурах эта зависимость не
значительна. Для практических целей
пользуются средними теплоемкостями
веществ в интервале температур от 298 К
до заданной температуры
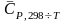 ,
которые приводятся в справочниках.
Температурный коэффициент теплового
эффекта, рассчитанный с использованием
средних теплоемкостей:
,
которые приводятся в справочниках.
Температурный коэффициент теплового
эффекта, рассчитанный с использованием
средних теплоемкостей:
|
(1.18) |
Тогда
 ,
,
откуда
|
(1.19) |
При стандартных условиях
|
(1.20) |
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при температуре 1000 К и стандартном давлении.
Решение: Для расчетов воспользуемся справочными данными по средним теплоемкостям участвующих в реакции веществ в интервале температур от 298 К до 1000 К (см. табл. 40 на стр.56 справочника [2]):
Средние теплоемкости |
СО(Г.) |
+ 2 Н2 (г.) |
= СН3ОН(г.) |
|
30,92 |
29,57 |
69,21 |
Изменение средней теплоемкости системы в результате протекания химической реакции:
|
|
Тепловой эффект при 1000 К равен
|
|

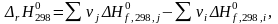
 ,
,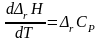 ,
,
 .
.
 ,
Дж/(моль∙К)
,
Дж/(моль∙К)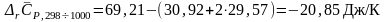
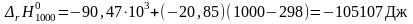 .
.