
- •Содержание
- •Введение
- •1 Химическая термодинамика и химическое равновесие
- •1.1 Первое начало термодинамики
- •1.2 Расчет тепловых эффектов химических реакций
- •Второе начало термодинамики
- •1.4 Расчет изменения энтропии и энергии Гиббса в химических процессах
- •1.5 Термодинамический анализ возможности протекания химического процесса
- •1.6 Химическое равновесие
- •1.7 Расчет степени превращения исходных веществ, выхода продукта и равновесного состава химической реакции
- •1.8 Константы равновесия гетерогенных реакций
- •1.9 Многовариантное задание №1 «Расчет степени превращения, равновесного состава и выхода продукта химической реакции и выбор оптимальных условий проведения процесса»
- •1.10 Многовариантное задание №2 «Расчет равновесных парциальных давлений гетерогенной химической реакции»
- •1.11 Контрольные вопросы
- •2 Фазовые равновесия
- •2.1 Однокомпонентные системы
- •2.1.1 Многовариантное задание №3 «Анализ фазового равновесия жидкость – пар в однокомпонентной системе»
- •2.2 Двухкомпонентные системы
- •2.2.1 Идеальные и неидеальные растворы
- •2.2.1.1 Многовариантное задание №4 «Определение активности и коэффициента активности растворителя в растворе»
- •2.2.1.2 Многовариантное задание № 5 «Коллигативные свойства растворов»
- •2.2.2 Диаграммы состав - свойство для равновесия жидкость - пар
- •2.2.2.1 Многовариантное задание № 6 «Анализ фазовых равновесий жидкость – пар в двухкомпонентной системе»
- •2.2.3 Диаграммы плавкости
- •2.2.3.1 Типы диаграмм плавкости. Основные понятия
- •2.2.3.2 Диаграмма плавкости, компоненты которой полностью не растворимы друг в друге и в жидком и в твердом состояниях
- •2.2.3.3 Диаграмма плавкости, компоненты которой неограниченно растворимы друг в друге в жидком и в твердом состояниях
- •2.2.3.4 Диаграмма плавкости, компоненты которой неограниченно растворимы в жидком и полностью не растворимы друг в друге в твердом состояниях
- •2.2.3.5 Диаграмма плавкости, компоненты которой ограниченно растворимы друг в друге в твердом состоянии
- •2.2.3.6 Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся без разложения
- •2.2.3.7 Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся с разложением
- •2.2.3.8 Примеры анализа диаграмм состояния
- •2.2.3.9 Многовариантное задание № 7 «Анализ диаграмм плавкости»
- •2.3 Контрольные вопросы
- •2.4 Вопросы к теоретическому коллоквиуму по теме «Фазовые равновесия»
- •3 Электрохимические системы
- •3.1 Гальванические элементы
- •3.1.1 Классификация электродов
- •3.1.2 Классификация гальванических элементов
- •3.1.3 Определение термодинамических параметров реакции, протекающей в гальваническом элементе
- •3.1.4 Многовариантное задание №8 «Гальванические элементы»
- •3.2 Электрическая проводимость растворов электролитов
- •3.2.1 Многовариантное задание № 9 «Электрическая проводимость растворов электролитов»
- •3.3 Контрольные вопросы
- •4 Методы определения строения вещества
- •4.1 Электрические свойства молекул
- •4.1.1 Многовариантное задание № 10 «Электрические свойства молекул»
- •4.1.2. Контрольные вопросы
- •4.2 Оптические методы изучения строения молекул. Молекулярные спектры
- •4.2.1 Общая характеристика молекулярных спектров
- •4.2.2 Закон Бугера-Ламберта-Бера
- •4.2.3 Энергия вращения двухатомной молекулы в приближении жесткого ротатора. Вращательные спектры молекул и их применение для определения молекулярных характеристик
- •4.2.4 Многовариантное задание № 11 «Вращательные спектры двухатомных молекул»
- •4.2.5 Колебательные спектры двухатомных молекул
- •4.2.6 Многовариантное задание №12 «Колебательные спектры двухатомных молекул»
- •4.3 Контрольные вопросы
- •5 Элементы статистической термодинамики
- •5.1 Многовариантное задание № 13 «Расчет теплоемкости идеального газа»
- •5.2 Контрольные вопросы
- •6 Химическая кинетика
- •6.1 Многовариантное задание № 14 «Расчет кинетических параметров гомогенных химических реакций»
- •6.2 Многовариантное задание № 15 «Влияние температуры на скорость химической реакции»
- •6.3 Контрольные вопросы
- •Литература основная
- •Дополнительная
- •Приложение (рекомендованное)
- •Предметный указатель
- •Физическая химия
- •190013, Санкт-Петербург, Московский пр., 26
Литература основная
1 Афанасьев, Б.Н. Физическая химия: учеб. пособие для вузов / Б.Н. Афанасьев, Ю.П. Акулова. – СПб.: Лань, 2012. – 464 с.
2 Краткий справочник физико-химических величин / Н.М. Барон и [и др.]; под ред. А.А. Равделя и А.М. Пономаревой. – 11-е изд. испр. и доп. – М.: ООО «ТИД «Аз-book», 2009. – 240 с.
3 Стромберг, А.Г. Физическая химия: учебник для вузов / А.Г. Стромберг, Д.П. Семченко – 5-е изд. испр. – М.: Высш. школа, 2009. – 527с.
Дополнительная
Физическая химия. В 2-х кн. / Под ред. К.С.Краснова. 3-е изд., испр. – М.: Высшая школа, 2001. – 512 с., 319 с.
Артемов, А.В.Физическая химия : учебник для учреждений высшего профессионального образования /А. В. Артемов. – М.: Академия, 2013. – 288 с.
Бёккер, Ю.Спектроскопия / Ю. Бёккер; пер. с нем. Л. Н. Казанцевой, под ред. А. А. Пупышева, М. В. Поляковой. – М. : Техносфера, 2009. – 527 с.
Грибов, Л.А. Колебания молекул /Л. А. Грибов; РАН. Ин-т геохимии и аналит. химии им. В. И. Вернадского. – М. : Кн. дом "ЛИБРОКОМ", 2009. – 542 с.
Ельяшевич, М.А. Атомная и молекулярная спектроскопия / М. А. Ельяшевич. – М.: Кн. дом "ЛИБРОКОМ", 2011. Ч. 1: Общие вопросы спектроскопии. – 5-е изд. – 2011. – 236 с.
Ротинян, А.Л. Теоретическая электрохимия: учебник для образоват. учреждений высш. проф. образования / А.Л. Ротинян, К.И. Тихонов, И.А. Шошина, А.М. Тимонов. – 2-е изд., перераб. и доп. – М.: Студент, 2013. – 496 с.
База данных ACerS-NIST PHASE EQUILIBRIA DIAGRAMS. Version 3.1.
Приложение (рекомендованное)
Правила оформления индивидуального задания
Индивидуальные задания выполняются на отдельных листах с указанием фамилии студента, номера группы, номера варианта и подварианта.
Решение каждого пункта задания следует доводить до конечного численного значения в тех единицах измерения, которые указаны в тексте задания. При использовании справочных данных обращайте внимание на единицы измерения соответствуюших величин, приведенных в таблицах.
При выполнении необходимых расчетов можно использовать традиционные компьютерные программы. Если расчеты проводятся с помощью калькулятора, необходимо учитывать правила приближенных вычислений. Недопустимо как слишком грубое округление приближенных чисел, так и проведение вычислений с точностью большей, чем та, которую допускают исходные данные. При округлении чисел лишние или неверные знаки надо отбрасывать, причем, если отбрасываемая цифра больше 5, то последняя сохраняемая цифра увеличивается на единицу. Если отбрасываемая часть состоит только из одной цифры 5, то округление делается так, чтобы последняя цифра осталась четной: 4,265 ≈ 4,26 и 4,255 ≈ 4,26.
При проведении вычислений надо руководствоваться приведенными ниже правилами.
При сложении и вычитании приближенных чисел в результате следует сохранять столько десятичных знаков, сколько их в слагаемом с наименьшим числом десятичных знаков. (Десятичными знаками числа называются те цифры, которые располагаются справа от знака дробности: так, в числе 0,043 – три десятичных знака, а в числе 273,2 – один десятичный знак, и т.п.). Если некоторое слагаемое алгебраической суммы имеет больше десятичных знаков, чем другие, то его предварительно следует округлить, сохраняя только одну лишнюю цифру. Например: 3,30 – 0,07 + 0,0078 ≈ 3,30 – 0,07 + 0,008 ≈ 3,24.
При умножении и делении в результате расчета следует сохранять столько значащих цифр, сколько их имеет исходное данное с наименьшим числом значащих цифр. (Значащими цифрами числа называются все его цифры, расположенные правее первой отличной от нуля цифры, включая эту цифру: так, в числе 0,043 – две значащие цифры, в числе 0,0430 – три значащие цифры, в числе 273,2 – четыре, а в числе 50 – две и т.д.). Если некоторые данные имеют больше значащих цифр, чем другие, то их предварительно следует округлить, сохраняя только одну лишнюю цифру. Например:
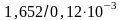 ≈
≈
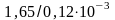 ≈
≈
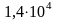
При вычислении промежуточных результатов следует брать одной цифрой больше, чем рекомендуют предыдущие правила. В окончательном результате эта “запасная цифра” отбрасывается. Сохранять “запасные цифры” в промежуточных расчетах особенно важно тогда, когда рассчитывается малая разность двух больших величин. Этот случай часто встречается в физико-химических расчетах.
При выполнении расчетов, в которых точность 1% является достаточной, логарифм приближенных чисел должен содержать три десятичных знака. Например, lga = 13,126;
lgb = 0,732; lgk = –0,003.
Графики выполняются с помощью компьютерных программ или на миллиметровой бумаге формата А4. При построении графиков необходимо руководствоваться правилами, указанными ниже.
Размер графика должен быть не меньше, чем половина листа.
Точность построения должна соответствовать точности измерений.
Продолжение приложения
Кривая или прямая должна занимать все поле чертежа и не быть слишком крутой или слишком пологой (желательно, чтобы угол наклона прямой был примерно 45°) – это обеспечивается правильным выбором соотношения масштабов по осям.
Масштаб следует выбирать таким образом, чтобы координаты любой точки можно было легко найти. Для этого масштабной единице должно соответствовать число, кратное 2, 5 или 10.
Масштабные единицы следует отмечать на осях координат через равные интервалы круглыми цифрами.
Точки должны четко наноситься на график в соответствии с выбранным масштабом, без нанесения дополнительных линий их координат и точных значений.
Физические величины, представленные на графиках, обозначают латинскими или греческими буквами на соответствующих осях, после которых через запятую обязательно ставятся соответствующие единицы измерений.
Графики должны быть подписаны. Из подписи должно быть ясно, какая зависимость приведена, для какой системы. В подписи недопустимы сокращения слов, кроме общепринятых.
