
- •Содержание
- •Введение
- •1 Химическая термодинамика и химическое равновесие
- •1.1 Первое начало термодинамики
- •1.2 Расчет тепловых эффектов химических реакций
- •Второе начало термодинамики
- •1.4 Расчет изменения энтропии и энергии Гиббса в химических процессах
- •1.5 Термодинамический анализ возможности протекания химического процесса
- •1.6 Химическое равновесие
- •1.7 Расчет степени превращения исходных веществ, выхода продукта и равновесного состава химической реакции
- •1.8 Константы равновесия гетерогенных реакций
- •1.9 Многовариантное задание №1 «Расчет степени превращения, равновесного состава и выхода продукта химической реакции и выбор оптимальных условий проведения процесса»
- •1.10 Многовариантное задание №2 «Расчет равновесных парциальных давлений гетерогенной химической реакции»
- •1.11 Контрольные вопросы
- •2 Фазовые равновесия
- •2.1 Однокомпонентные системы
- •2.1.1 Многовариантное задание №3 «Анализ фазового равновесия жидкость – пар в однокомпонентной системе»
- •2.2 Двухкомпонентные системы
- •2.2.1 Идеальные и неидеальные растворы
- •2.2.1.1 Многовариантное задание №4 «Определение активности и коэффициента активности растворителя в растворе»
- •2.2.1.2 Многовариантное задание № 5 «Коллигативные свойства растворов»
- •2.2.2 Диаграммы состав - свойство для равновесия жидкость - пар
- •2.2.2.1 Многовариантное задание № 6 «Анализ фазовых равновесий жидкость – пар в двухкомпонентной системе»
- •2.2.3 Диаграммы плавкости
- •2.2.3.1 Типы диаграмм плавкости. Основные понятия
- •2.2.3.2 Диаграмма плавкости, компоненты которой полностью не растворимы друг в друге и в жидком и в твердом состояниях
- •2.2.3.3 Диаграмма плавкости, компоненты которой неограниченно растворимы друг в друге в жидком и в твердом состояниях
- •2.2.3.4 Диаграмма плавкости, компоненты которой неограниченно растворимы в жидком и полностью не растворимы друг в друге в твердом состояниях
- •2.2.3.5 Диаграмма плавкости, компоненты которой ограниченно растворимы друг в друге в твердом состоянии
- •2.2.3.6 Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся без разложения
- •2.2.3.7 Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся с разложением
- •2.2.3.8 Примеры анализа диаграмм состояния
- •2.2.3.9 Многовариантное задание № 7 «Анализ диаграмм плавкости»
- •2.3 Контрольные вопросы
- •2.4 Вопросы к теоретическому коллоквиуму по теме «Фазовые равновесия»
- •3 Электрохимические системы
- •3.1 Гальванические элементы
- •3.1.1 Классификация электродов
- •3.1.2 Классификация гальванических элементов
- •3.1.3 Определение термодинамических параметров реакции, протекающей в гальваническом элементе
- •3.1.4 Многовариантное задание №8 «Гальванические элементы»
- •3.2 Электрическая проводимость растворов электролитов
- •3.2.1 Многовариантное задание № 9 «Электрическая проводимость растворов электролитов»
- •3.3 Контрольные вопросы
- •4 Методы определения строения вещества
- •4.1 Электрические свойства молекул
- •4.1.1 Многовариантное задание № 10 «Электрические свойства молекул»
- •4.1.2. Контрольные вопросы
- •4.2 Оптические методы изучения строения молекул. Молекулярные спектры
- •4.2.1 Общая характеристика молекулярных спектров
- •4.2.2 Закон Бугера-Ламберта-Бера
- •4.2.3 Энергия вращения двухатомной молекулы в приближении жесткого ротатора. Вращательные спектры молекул и их применение для определения молекулярных характеристик
- •4.2.4 Многовариантное задание № 11 «Вращательные спектры двухатомных молекул»
- •4.2.5 Колебательные спектры двухатомных молекул
- •4.2.6 Многовариантное задание №12 «Колебательные спектры двухатомных молекул»
- •4.3 Контрольные вопросы
- •5 Элементы статистической термодинамики
- •5.1 Многовариантное задание № 13 «Расчет теплоемкости идеального газа»
- •5.2 Контрольные вопросы
- •6 Химическая кинетика
- •6.1 Многовариантное задание № 14 «Расчет кинетических параметров гомогенных химических реакций»
- •6.2 Многовариантное задание № 15 «Влияние температуры на скорость химической реакции»
- •6.3 Контрольные вопросы
- •Литература основная
- •Дополнительная
- •Приложение (рекомендованное)
- •Предметный указатель
- •Физическая химия
- •190013, Санкт-Петербург, Московский пр., 26
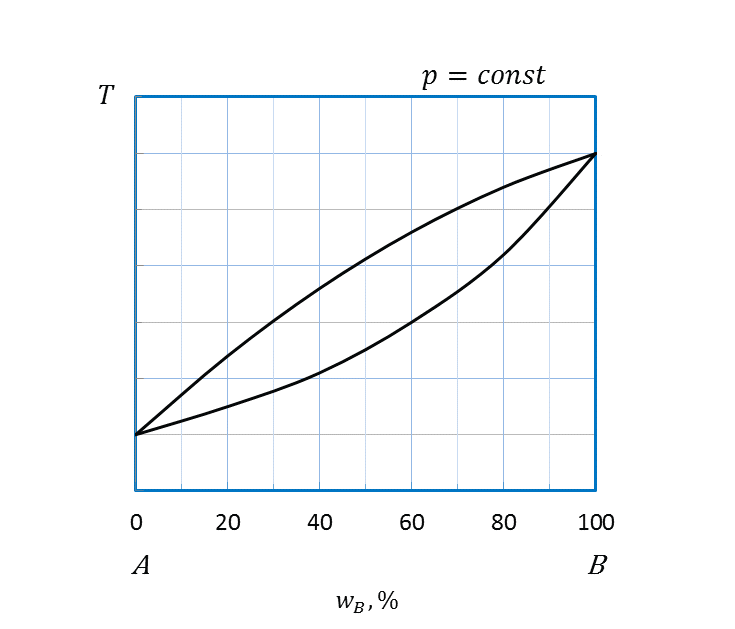
2.2.3.3 Диаграмма плавкости, компоненты которой неограниченно растворимы друг в друге в жидком и в твердом состояниях
Неограниченная растворимость компонентов и в жидком и твердом агрегатных состояниях проявляется на диаграммах (рисунок 2.25) так же, как и на диаграммах состояниях жидкость – пар.
Твердые растворы – это однородные кристаллические или аморфные фазы, сохраняющие однородность при изменении соотношения между компонентами.
Частный случай твердых растворов – изоморфные смеси или твердые растворы замещения. В таких растворах общая кристаллическая решетка построена веществами с близкими кристаллографическими характеристиками, размером частиц и химической природой. Замещение частиц происходит неупорядоченно (статистически).
Непрерывные твердые растворы замещения подобны неограниченно смешивающимся жидкостям, а диаграммы плавкости похожи на соответствующие диаграммы перегонки, подчиняются правилам Розебома, схожим с законами Гиббса-Коновалова.
I правило Розебома: твердый раствор по сравнению с сосуществующей с ним жидкостью относительно обогащен тем компонентом, добавление которого повышает температуру начала равновесной кристаллизации.
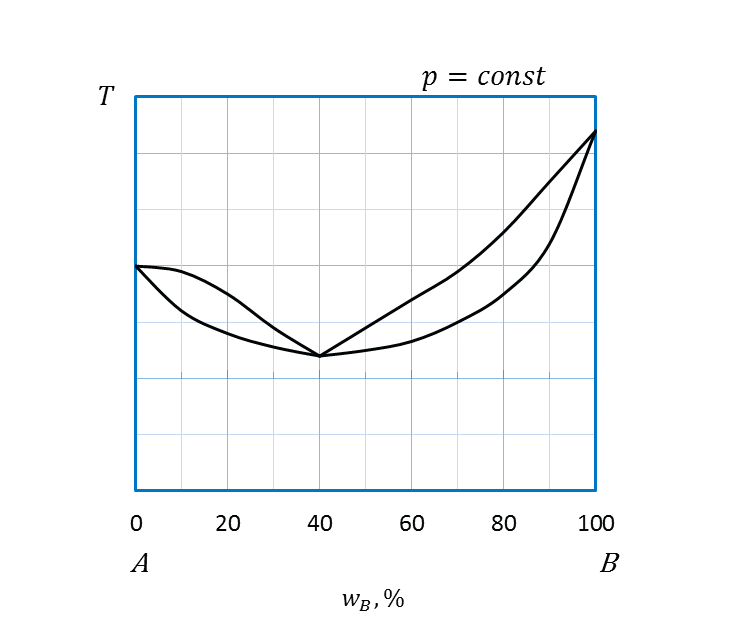
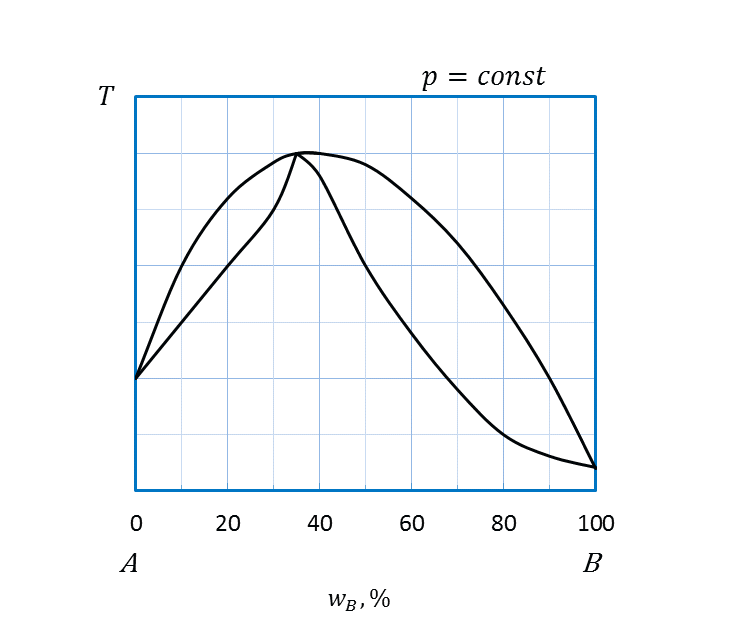
II правило Розебома: в точках экстремумов диаграмм плавкости равновесные твердые и жидкие фазы имеют одинаковый состав. В этих точках линии ликвидуса и солидуса имеют общую касательную (рисунок 2.25 б,в).
Анализ диаграммы состояния (рисунок 2.25 a) показывает, что выше кривой ликвидуса в области I система является гомогенной. В этой области находится двухкомпонентный расплав или раствор компонентов A и B. При охлаждении системы, например, состава a’ (рисунок 2.26) по достижении кривой ликвидуса начинается кристаллизация двухкомпонентного твердого раствора. Фигуративная точка a’ отвечает началу выпадения кристаллов, точка a’’ на кривой солидуса – температуре конца кристаллизации. В интервале температур a’a’’ (область II) система является гетерогенной, т.е. двухфазной, состоит из двухкомпонентных расплава и твердого раствора. Ниже температуры, отвечающей точке a’’, система вновь гомогенная, в области III находится одна фаза - твердый раствор А и В.
Анализ диаграмм состояния с точками экстремумов (рисунок 2.25 б,в) проводят аналогично. Особенностью этих диаграмм является наличие двух гетерогенных областей сосуществования равновесных расплава и твердого раствора (области II, III).
В области существования гомогенного твердого раствора возможно уменьшение растворимости системы, что проявляется в появлении линии, ограничивающей область распада твердых растворов (рисунок 2.27). Это явление называют разрывом сплошности твердого раствора. Кривая akb показывает принципиальную возможность распада гомогенного твердого раствора на два взаимно насыщенных твердых раствора компонента B в A и компонента A в B. При быстром охлаждении разрыва сплошности может не быть, тогда система останется в термодинамически неустойчивом состоянии твердого раствора.
Tfus.А
Tfus.В
I
II
III
a
б
в

I
II
III
IV
Tfus.А
Tfus.А
Tfus.В
Tfus.В
I
II
III
IV
Области:
а: I – двухкомпонентный расплав A и B;
II – двухкомпонентный расплав A и B и твердый раствор компонентов А и В;
III – твердый раствор А и В;
б,в: I –двухкомпонентный расплав A и B;
II, III – двухкомпонентный расплав A и B и твердый раствор А и В;
IV – твердый раствор А и В.
Рисунок 2.25 - Диаграммы состояния А – B, компоненты которых полностью растворимы друг в друге в жидком и твердом состояниях

Рисунок 2.26 - Диаграмма состояния A – B.
Процесс охлаждения расплава a
Tfus.В
Tfus.А
k
a
b


Рисунок 2.27 - Диаграмма состояния A – B.
Распад твердого раствора
