
- •1 Расчет материального баланса
- •1.1 Исходные данные
- •1.2 Расчет шихты
- •1.2.1 Выплавка рудноизвесткового расплава
- •1.2.2 Расчет твердой добавки
- •1.2.3 Расчет восстановителя
- •1.3 Расчет состава и количества металла
- •1.4 Расчёт состава и количества шлака
- •1.5 Расчет количества газов
- •1.6 Расчет материального баланса
- •1.7 Расчет удельного расхода материалов
- •1.7.1 Удельный расход хромовой руды
- •1.7.2 Удельный расход извести
- •2 Расчет теплового баланса
- •2.1 Приход тепла
- •2.1.1 Физическое тепло шихты
- •2.1.2 Экзотермическое тепло реакций
- •2.2 Расход тепла
- •2.2.1 Теплосодержание сплава при температуре выпуска
- •2.2.2 Теплосодержание шлака при температуре выпуска
- •2.2.3 Теплосодержание газообразных продуктов
- •2.2.4 Тепло эндотермических реакций
- •2.2.5 Потери тепла
- •2.2.6 Избыток тепла
- •2.3 Тепловой баланс
2.1.2 Экзотермическое тепло реакций
Статья включает тепло реакций окисления Qэкз.ок., тепло реакций восстановления Qэкз.восст., тепло металлообразования Qэкз.мет. и тепло шлакообразования Qэкз.шл.. Тепло от окисления силиковосстановителей на колошнике, растворения кремния в сплаве, образования силикатов и шпинелидов в шлаке рассчитывают по количеству окислившегося элемента или образовавшегося соединения gi и соответствующему тепловому эффекту:
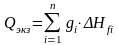
Qэкз = Qэкз.ок + Qэкз.восст + Qэкз.мет + Qэкз.шл
1. Тепло реакций окисления Qэкз.ок выделяется при окислении кремния кислородом воздуха по реакции:
Si + О2 = SiO2 ΔH= -911,55 кДж/моль
Qэкз. ок. = (22,790 · 0,4942 · 0,06) · 911,55 / 0,028 = 22000 кДж
2. Тепло реакций восстановления Qэкз.восст выделяется при восстановлении хрома, железа и фосфора по реакциям:
1. 2Cr2O3 + 3Si= 4Cr + 3SiO2 ΔН = -2734,65 + 2 · 1141,32 = -452,01 кДж/моль;
Q1 = (17,364 + 2,866) · 452,01 / (4∙ 0,052) = 43964 кДж.
2. 2FeO + Si = 2Fe + SiO2 ΔН = -911,55+ 2 · 265,44 = -380,67 кДж/моль;
Q2 = 0,865 · 380,67 / (2 ∙ 0,056) = 2940 кДж.
3. 2Fe2O3 + 3Si = 4Fe + 3SiO2 ΔН = 3·(-911,55) + 2 · 822,2 = -1090,25 кДж/моль;
Q3 = 5,260 · 1090,25 / (4 ∙ 0,056) = 25602 кДж.
4. 2Р2O5 + 5Si = 4Р + 5 SiO2 ΔН = -4557,75+2 · 1530,5 =-1496,75 кДж/моль;
Q4 = 0,003 · 1496,75 / (4 ∙ 0,031) = 31 кДж.
Qэкз.восст. = 43964 + 2940 + 25602 + 31 = 72537 кДж.
3. Тепло металлообразования Qэкз.мет. складывается в основном из реакций образования в сплаве карбидов и силицидов (остальным пренебрегаем). Принимаем, что весь углерод в феррохроме связан только с хромом и присутствует в виде Cr23C6. Образование карбида хрома происходит по реакции
23Cr + 6C =Cr23C6 ΔH = - 411,480 кДж/моль.
Также принимаем, что весь кремний в феррохроме связан только с железом и присутствует в виде FeSi. Образование силицида железа происходит по реакции
Fe + Si = FeSi ΔH = - 80,38 кДж/моль.
При растворении 0,005 кг углерода в феррохроме выделится тепла
Q1 = 0,005 · 411,480 / (6 · 0,012) = 29 кДж.
При растворении 0,225 кг кремния в феррохроме выделится тепла
Q2 = 0,225 · 80,38 / 0,028 = 647 кДж.
Таким образом, Qэкз.мет. = 29 + 647 = 675 кДж.
4. Тепло шлакообразования Qэкз.шл складывается в основном из реакций образования в шлаке двухкальциевого силиката и шпинели (остальным пренебрегаем ). Принимаем, что весь оксид алюминия в шлаке связан только с оксидом магния и присутствует в шпинели MgO∙Al2O3. Образование шпинели из оксидов происходит по реакции
MgO + Al2O3 = MgO · Al2O3 ΔH =-2302,32+601,89+1676,81 = - 23,62 кДж/моль.
Также принимаем, что весь кремнезем связан с оксидом кальция и присутствует в шлаке в виде ларнита 2CaO·SiO2. Образование ларнита происходит по реакции
2СаO + SiO2 = 2СаO∙SiO2 ΔH =-2308,98 + 2·635,6+ 911,55 = -126,23 кДж/моль.
При образовании шпинели из 4,666 кг оксида алюминия выделится тепла
Q1 = 4,666· 23,62 / (0,102) = 1157 кДж.
29,411кг кремнезема связывается в ларнит, при этом выделится тепла
Q2 = 29,411 · 126,23 / 0,060 = 61876 кДж.
Таким образом, при шлакообразовании выделится тепла
Qэкз.шл = 1157 + 61876 = 63032 кДж.
Qэкз. = 22000 + 72537 + 675 + 63032 = 158245 кДж.
Всего приход тепла составит 366234 + 158245 = 524478 кДж.
