
- •Курс лекций по общей химии
- •Содержание тем:
- •1. Химия и экология
- •Охрана воздушного бассейна
- •2.Строение атома
- •2.1. Квантовые числа
- •2.2. Принцип Паули
- •2.3. Принцип наименьшей энергии
- •2.4. Правило Хунда
- •2.5. Изображение электронного строения атома
- •Контрольные варианты
- •3. Периодическая система элементов д. И. Менделеева
- •Периодические свойства элементов
- •4. Химическая связь
- •4.1. Свойства ковалентной связи
- •4.2. Гибридизация атомных орбиталей
- •4.3. Полярные и неполярные молекулы
- •4.4. Металлическая связь
- •5.Энергетика химических процессов
- •6.Химическая кинетика.
- •7.Химическое равновесие.
- •Вопросы для самоконтроля по теме: «Закономерности протекания химических реакций»
- •Задачи по теме:
- •8.1. Способы выражения концентрации растворов
- •8.2. Примеры решения задач
- •8.2.1. Вычисления количеств компонентов раствора
- •322 Г Na2so4 × 10 h2o содержат - 142 г Na2so4
- •8.2.2. Вычисления при приготовлении разбавленных растворов из концентрированных
- •8.2.3. Вычисления при смешивании растворов
- •8.2.4. Пересчет концентрации из одной формы выражения в другую
- •8.2.5. Вычисления при химических реакциях
- •Контрольные вопросы и задачи
- •9.Свойства разбавленных растворов неэлектролитов
- •I закон Рауля:
- •II закон Рауля:
- •10. Растворы электролитов
- •11. Ионномолекулярные уравнения
- •12. Произведение растворимости
- •13. Ионное произведение воды. Водородный показатель.
- •14. Гидролиз солей
- •15. Дисперсные системы
- •16.1.Классификация дисперсных систем. Получение. Свойства и структура коллоидных систем
- •Методы получения дисперсных систем.
- •16. Химическая идентификация и анализ вещества
- •16.1. Химическая идентификация и анализ вещества
- •Вопросы и задачи для самоконтроля
- •16.2. Количественный анализ. Химические методы анализа
- •Вопросы и задачи для самоконтроля
- •16.3. Инструментальные методы анализа
- •Вопросы и задачи для самоконтроля
- •17. Окислительно-восстановительные реакции (овр)
- •Порядок нахождения степени окисления:
- •Ионно-электронный метод
- •18. Электрохимические процессы
- •18.1. Электродный потенциал
- •18.2. Гальванический элемент Даниэля – Якоби
- •18.3. Электродвижущая сила элемента (эдс)
- •18.4. Потенциалы металлических и газовых электродов
- •Ряд напряжений металлов:
- •19.Электролиз
- •Примеры
- •Электролиз с нерастворимым анодом водного раствора Na2so4:
- •20. Коррозия и защита металлов
- •20.1. Защита от коррозии. Металлические покрытия
- •21. Общие свойства металлов
- •21.1. Физические свойства металлов
- •21.2. Химические свойства металлов Отношение металлов к кислороду воздуха
- •Отношение металлов к воде
- •Это обусловлено наличием на поверхности алюминия очень плотного тонкого слоя химически инертной оксидной пленки, которая ни при каких условиях не взаимодействует с водой.
- •Отношение металлов к растворам кислот
- •А потенциал электродного процесса
- •Отношение некоторых металлов к кислотам
- •Отношение металлов к растворам щелочей
- •Электронные процессы
- •Отношение некоторых металлов к водным растворам щелочей
- •Отношение металлов к растворам солей
- •21.3. Природные соединения металлов
- •Контрольные вопросы
- •22.Жесткость и умягчение воды
- •Контрольные вопросы и задачи
- •23.Определение качественного состава природных вод
- •Общее содержание меди в земной коре сравнительно невелико, однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
- •Некоторые свойства меди и ее аналогов
- •25. Ощая характеристика металлов 2 группы побочной подгруппы. Цинк
- •Некоторые свойства элементов побочной подгруппы
- •Контрольные вопросы
- •26. Общая характеристика металлов побочной подгруппы VI группы. Хром.
- •Хром 5224 Сr
- •27. Общая характеристика металлов побочной подгруппы
- •VII группы.Марганец.
- •Марганец 55 25Мп
- •Соединения марганца
- •Вопросы и задачи:
- •28. Железо 56 26Fe.
- •Соединения железа
- •29. Общая характеристика р-металлов
- •111 Группы побочной подгруппы. Алюминий.
- •Контрольные вопросы.
- •30. Общая характеристика р-металлов 4 группы побочной подгруппы. Олово, свинец.
- •Контрольные вопросы
- •31.Комплексные соединения.
- •31.1.Основные положения координационной теории
- •31.2 Номенклатура комплексных соединений
- •31.3.Устойчивость комплексных соединений
- •Классификация неорганических соединений
- •Классификация неорганических соединений
- •32.1. Оксиды. Номенклатура, классификация оксидов
- •32.2. Получение оксидов и их свойства. Основные, кислотные и амфотерные оксиды
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.3. Гидроксиды (основания). Номенклатура, классификация гидроксидов
- •32.4. Свойства оснований
- •32.5. Понятие об амфотерных гидроксидах
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •Кислоты. Классификация, номенклатура кислот
- •32.7. Свойства кислот
- •Формулы и названия важнейших кислот и их солей
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.8.Соли. Классификация солей
- •33. Органические полимерные материалы
- •33.1. Методы получения полимеров
- •2Nh2-(сн2)5-соон →
- •Вопросы для самоконтроля
- •33.2. Строение полимеров
- •Вопросы для самоконтроля
- •33.3. Свойства полимеров
- •Вопросы для самоконтроля
- •33.4. Применение полимеров
- •Вопросы для самоконтроля
4. Химическая связь
Различают 3 основных типа химической связей: ковалентную, ионную и металлическую.
Механизм возникновения ковалентной связи:
Н + Н = Н2; DH = -436 кДж/моль.

Рис.2. Схема перекрывания электронных орбиталей при образовании молекулы водорода
Наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей (рис.2.)
Изображение химической связи:
Н + Н ® Н : Н

2) 1s1 1s1

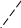
1s2
+ или
или
3) H — H
. . . . . . . .
П
 ример:
:
Cl
∙ + ∙ Cl
: : Cl
: Cl
:
ример:
:
Cl
∙ + ∙ Cl
: : Cl
: Cl
:
 .
. . .
. . . .
.
. . .
. . . .
неподеленная неспаренный общая
пара электронов электрон поделенная пара электронов

Рис.3. Схема образования химической связи в молекулах хлора Cl2 (a) и хлороводорода HCl (б)
Химическая связь, осуществляемая электронными парами, называется ковалентной. Различают неполярную ковалентную связь и полярную ковалентную связь (рис.3.)
Неполярная связь: H2, Cl2, O2, N2: H : H
. .
Полярная связь: HCl, H2O, H2S: Hd+ :Cld-: (ЭОCl = 2,83; ЭОН = 2,1)
. .
Ковалентная связь образуется за счет: а) перекрывания электронных облаков; б) по донорно-акцепторному механизму.
H
H

 . .
. .
. .
. .
H : N
: + H+
®
H
:
N
:
H
(NH3
+ H+
®
NH+4)
: N
: + H+
®
H
:
N
:
H
(NH3
+ H+
®
NH+4)
H
H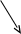
 . .
. .
. .
. .
донор акцептор
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
4.1. Свойства ковалентной связи
Длина связи – это межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина.
Энергия связи – определяется количеством энергии, которое необходимо для разрыва связи.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей.
Например: Н – неспаренный ℮ - 1 связь Н — Н;
Н

С* - 4 неспаренных ℮ - 4 связи Н - С – Н;
Н
Направленность – обусловливает пространственную структуру молекул, т.е. их геометрию (форму). Рассмотрим это на примере образования молекул Н2О (рис.) и NH3 (рис.5.)
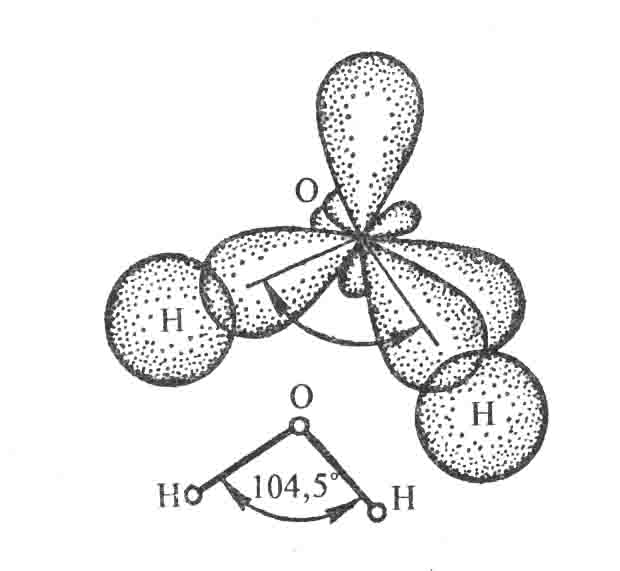
. Рис.4. Схема образования химических связей в молекуле H2O
Форма молекулы воды – угловая.
О+7 1s22s22p4 – 2 неподеленные пары, 2 неспаренных электрона.
ÐНОН = 104,5°.

Рис. 5. Схема образования химических связей в молекуле NH3
Форма молекулы аммиака – пирамидальная.
N+7 1s2 2s2 2p3 – 3 неспаренных электрона.
ÐНОН = 107,3°. Углы между связями называются валентными.
