
- •Курс лекций по общей химии
- •Содержание тем:
- •1. Химия и экология
- •Охрана воздушного бассейна
- •2.Строение атома
- •2.1. Квантовые числа
- •2.2. Принцип Паули
- •2.3. Принцип наименьшей энергии
- •2.4. Правило Хунда
- •2.5. Изображение электронного строения атома
- •Контрольные варианты
- •3. Периодическая система элементов д. И. Менделеева
- •Периодические свойства элементов
- •4. Химическая связь
- •4.1. Свойства ковалентной связи
- •4.2. Гибридизация атомных орбиталей
- •4.3. Полярные и неполярные молекулы
- •4.4. Металлическая связь
- •5.Энергетика химических процессов
- •6.Химическая кинетика.
- •7.Химическое равновесие.
- •Вопросы для самоконтроля по теме: «Закономерности протекания химических реакций»
- •Задачи по теме:
- •8.1. Способы выражения концентрации растворов
- •8.2. Примеры решения задач
- •8.2.1. Вычисления количеств компонентов раствора
- •322 Г Na2so4 × 10 h2o содержат - 142 г Na2so4
- •8.2.2. Вычисления при приготовлении разбавленных растворов из концентрированных
- •8.2.3. Вычисления при смешивании растворов
- •8.2.4. Пересчет концентрации из одной формы выражения в другую
- •8.2.5. Вычисления при химических реакциях
- •Контрольные вопросы и задачи
- •9.Свойства разбавленных растворов неэлектролитов
- •I закон Рауля:
- •II закон Рауля:
- •10. Растворы электролитов
- •11. Ионномолекулярные уравнения
- •12. Произведение растворимости
- •13. Ионное произведение воды. Водородный показатель.
- •14. Гидролиз солей
- •15. Дисперсные системы
- •16.1.Классификация дисперсных систем. Получение. Свойства и структура коллоидных систем
- •Методы получения дисперсных систем.
- •16. Химическая идентификация и анализ вещества
- •16.1. Химическая идентификация и анализ вещества
- •Вопросы и задачи для самоконтроля
- •16.2. Количественный анализ. Химические методы анализа
- •Вопросы и задачи для самоконтроля
- •16.3. Инструментальные методы анализа
- •Вопросы и задачи для самоконтроля
- •17. Окислительно-восстановительные реакции (овр)
- •Порядок нахождения степени окисления:
- •Ионно-электронный метод
- •18. Электрохимические процессы
- •18.1. Электродный потенциал
- •18.2. Гальванический элемент Даниэля – Якоби
- •18.3. Электродвижущая сила элемента (эдс)
- •18.4. Потенциалы металлических и газовых электродов
- •Ряд напряжений металлов:
- •19.Электролиз
- •Примеры
- •Электролиз с нерастворимым анодом водного раствора Na2so4:
- •20. Коррозия и защита металлов
- •20.1. Защита от коррозии. Металлические покрытия
- •21. Общие свойства металлов
- •21.1. Физические свойства металлов
- •21.2. Химические свойства металлов Отношение металлов к кислороду воздуха
- •Отношение металлов к воде
- •Это обусловлено наличием на поверхности алюминия очень плотного тонкого слоя химически инертной оксидной пленки, которая ни при каких условиях не взаимодействует с водой.
- •Отношение металлов к растворам кислот
- •А потенциал электродного процесса
- •Отношение некоторых металлов к кислотам
- •Отношение металлов к растворам щелочей
- •Электронные процессы
- •Отношение некоторых металлов к водным растворам щелочей
- •Отношение металлов к растворам солей
- •21.3. Природные соединения металлов
- •Контрольные вопросы
- •22.Жесткость и умягчение воды
- •Контрольные вопросы и задачи
- •23.Определение качественного состава природных вод
- •Общее содержание меди в земной коре сравнительно невелико, однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
- •Некоторые свойства меди и ее аналогов
- •25. Ощая характеристика металлов 2 группы побочной подгруппы. Цинк
- •Некоторые свойства элементов побочной подгруппы
- •Контрольные вопросы
- •26. Общая характеристика металлов побочной подгруппы VI группы. Хром.
- •Хром 5224 Сr
- •27. Общая характеристика металлов побочной подгруппы
- •VII группы.Марганец.
- •Марганец 55 25Мп
- •Соединения марганца
- •Вопросы и задачи:
- •28. Железо 56 26Fe.
- •Соединения железа
- •29. Общая характеристика р-металлов
- •111 Группы побочной подгруппы. Алюминий.
- •Контрольные вопросы.
- •30. Общая характеристика р-металлов 4 группы побочной подгруппы. Олово, свинец.
- •Контрольные вопросы
- •31.Комплексные соединения.
- •31.1.Основные положения координационной теории
- •31.2 Номенклатура комплексных соединений
- •31.3.Устойчивость комплексных соединений
- •Классификация неорганических соединений
- •Классификация неорганических соединений
- •32.1. Оксиды. Номенклатура, классификация оксидов
- •32.2. Получение оксидов и их свойства. Основные, кислотные и амфотерные оксиды
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.3. Гидроксиды (основания). Номенклатура, классификация гидроксидов
- •32.4. Свойства оснований
- •32.5. Понятие об амфотерных гидроксидах
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •Кислоты. Классификация, номенклатура кислот
- •32.7. Свойства кислот
- •Формулы и названия важнейших кислот и их солей
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.8.Соли. Классификация солей
- •33. Органические полимерные материалы
- •33.1. Методы получения полимеров
- •2Nh2-(сн2)5-соон →
- •Вопросы для самоконтроля
- •33.2. Строение полимеров
- •Вопросы для самоконтроля
- •33.3. Свойства полимеров
- •Вопросы для самоконтроля
- •33.4. Применение полимеров
- •Вопросы для самоконтроля
32.8.Соли. Классификация солей
Солью называют сложное вещество – продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или продукт полного или частичного замещения гидроксигруппы в молекуле основания на кислотный остаток.
Всякая соль состоит из основного и кислотного остатков. Средние соли диссоциируют на катионы металлов и анионы кислотных остатков.
KCl « K+ + Cl-
(NH4)2SO4 « 2NH4+ + SO42-
Na3PO4 « 3 Na+ + PO43-
Например, из серной кислоты H2SO4 можно получить два типа солей: Na2SO4 - продукт полного замещения водорода на атомы натрия и NaHSO4 – продукт частичного замещения атомов водорода. В зависимости от полноты замещения различают средние, кислые и основные соли.
Средние или нормальные соли: например, MgSO4, K2SO4, Ca3(PO4)2 – продукты полного замещения атомов водорода в молекуле кислоты на атомы металлы:
H2SO4 + 2 KOH = K2SO4 + 2 H2O
Кислые соли: например, KHSO4, Ca(H2PO4)2, CaHPO4 – продукт неполного, частичного замещения атомов водорода в молекуле кислоты на атом металла.
H2SO4 + KOH = KHSO4 + H2O
Кислые соли образуются многоосновными кислотами. При диссоциации кислых солей вначале образуются ионы металлов, а затем ионы водорода. Например:
KHSO4 « K+ + HSO4-
HSO4 « H+ + SO42-
Основные соли: например, Al(OH)SO4, MgOHCl – продукт частичного замещения гидроксигрупп в молекуле основания на кислотный остаток.
Fe(OH)3 + H2SO4 = FeOHSO4 + 2 H2O
Основные соли образуются только многокислотными основаниями. У основных солей вначале образуются кислотные остатки, а затем гидроксид-ионы. Например:
Mg(OH)Cl « Mg(OH)+ + Cl-
Mg(OH)+ « Mg2+ + OH-
33. Органические полимерные материалы
Полимеры - высокомолекулярные соединения, которые характеризуются молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые также макромолекулам, состоят из большого числа повторяющихся звеньев. Вследствие большой молекулярной массы макромолекул полимеры приобретают некоторые специфические свойства. Поэтому они выделены в особую группу химических соединений.
Отдельную группу также составляют олигомеры, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями
Различают неорганические, органические и элементоорганические полимеры. Органические полимеры, в свою очередь, подразделяют на природные и синтетические. В настоящей главе рассматриваются в основном органические синтетические полимеры.
33.1. Методы получения полимеров
Полимеры получают методами полимеризации или поликонденсации.
Полимеризация (полиприсоединение). Это реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Большой вклад в изучении процессов полимеризации внесли отечественные ученые С.В.Лебедев, С.С.Медведев и др. и зарубежные исследователи Г.Штаудингер, Г.Марк, К.Циглер и др. При полимеризации не образуются побочные продукты и соответственно элементный состав макромолекул не отличается от состава молекул мономеров. В качестве мономеров используются соединения с кратными связями: СС, СN, С=С, СО, С=С=О,С=С=С, С=N, либо соединения с циклическими группами, способными раскрываться, например:
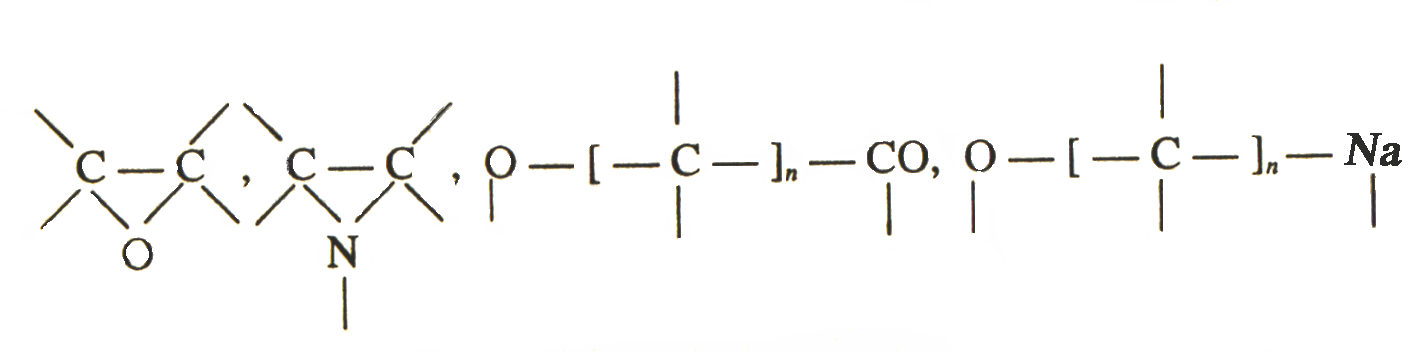
В процессе полимеризации происходит разрыв кратных связей или раскрытие циклов у мономеров и возникновение химических связей между группами с образованием макромолекул, например:

По числу видов участвующих мономеров различают гомополимеризацию (один вид мономера) и сополимеризацию (два и более видов мономеров).
Полимеризация - самопроизвольный экзотермический процесс (С<0, Н<0), так как разрыв двойных связей ведет к уменьшению энергии системы. Однако без внешних воздействий (инициаторов, катализаторов и т.д.) полимеризация протекает обычно медленно. Политизация является цепной реакцией. В зависимости от характера активных частиц различают радикальную и ионную полимеризации.
При радикальной полимеризации процесс инициируется свободными радикалами. Реакция проходит через несколько стадий: а) инициирование; б) рост цепи; в) передача или обрыв цепи:
а) инициирование - образование активных центров - радикалов и макрорадикалов — происходит в результате теплового, фотохимического, химического, радиационного или других видов воздействий. Чаще всего инициаторами полимеризации служат пероксиды, азотосоединения (имеющие функциональную группу - N = N -) и другие единения с ослабленными связями. Первоначально образуются радикалы, например:

Затем образуются макрорадикалы, например при полимеризации хлорвинила:
R + СН2 = СНС1 → ЯСН2 - СНСl
RСН2 — СНСl + СН2 = СНСl → RСН2 — СНСl — СН2 — СНС1 и т.д.;
б) рост цепи происходит за счет присоединения к радикалам образующихся мономеров с получением новых радикалов;
в) передача цепи заключается в переносе активного центра на другую молекулу (мономер, полимер, молекулы растворителя):
R-(-СН2-СНС1-)n-СН2-СНСl+СН2=СНС1→
→ R-(-СН2-СНС1-)n-СН2-СН2С1 + СН = СНСl
В результате рост цепи прекращается, а молекула-передатчик, в данном случае молекула мономера, инициирует новую реакционную цепь. Если передатчиком служит полимер, то может произойти разветвление цепи.
В стадии обрыва цепи происходит взаимодействие радикалов с образованием валентно-насыщенных молекул:
R-(-СН2-СНС1-)n-СН2-СНСl+ R-(-СН2-СНС1-)n-СН2-СНСl →
→ R- (-СН2- СНС1-)n- СН2- СНС1 - СН2- СНС1- (-СН2-СНС1)n - R
Обрыв цепи может также произойти при образовании малоактивных радикалов, которые не способны инициировать реакцию. Такие вещества называют ингибиторами.
Таким образом, регулирование длины и соответственно молекулярной массы макромолекул можно осуществлять с помощью инициаторов, ингибиторов и других веществ. Тем не менее передача и обрыв цепи могут происходить на различных этапах роста цепи, этому макромолекулы имеют различную молекулярную массу, т.е. полидисперсны. Полидисперсность является отличительной особенностью полимеров.
Радикальная полимеризация служит промышленным способом синтеза многих важных полимеров таких, как поливинилхлорид [СН-СНС1-]n, поливинилацетат [-СН2-СН(ОСОСН3)-]n, полистирол [CН2-СН(С6Н5)-]n, полиакрилат [-СН2-С(СН3)(СООК)-]n, полиэтилен [-СН2-СН2-]n, полидиены [-CН2-С(R)=СН-СН2-]n, и различных сополимеров.
Ионная полимеризация также происходит через стадию образования активных центров, роста и обрыва цепи. Роль активных центров в этом случае играют анионы и катионы. Соответственно различают анионную и катионную полимеризацию. Инициаторами катионной полимеризации служат электроноакцепторные соединения, в том числе протонные кислоты, например Н2SO4 и НС1, органические протонные кислоты (SnСl4, ТiCl4, А1С13 и др.), металлоорганические соединения А1(С2Н5)з и др. В качестве инициаторов анионной полимеризации используются элекронодонорные вещества и соединения, в том числе щелочные и щелочноземельные металлы, алкоголяты щелочных металлов и др. Часто одновременно используется несколько инициаторов полимеризации.
Рост цепи можно записать уравнениями реакции:
при катионной полимеризации и
Mn+ + M → Mn+1+
при анионной полимеризации
Mn- + M → Mn+1-
Рассмотрим в качестве примера катионную полимеризацию изобутилена с инициаторами А1С13 и Н2О. Последние образуют комплекс
А1С13 + Н2О ↔ Н+[А1ОНС13]–
Обозначив этот комплекс формулой Н+Х–, процесс инициирования полимеризации можно представить в виде

Возникающий комплексный катион вместе с противоионом X– образует макроион, который обеспечивает рост цепи:

С помощью некоторых комплексных инициаторов удается получить полимеры, имеющие регулярную структуру (стереорегулярные полимеры). Например, таким комплексным инициатором может быт комплекс тетрахлорида титана и триалкилалюминия А1R3.
Метод ионной полимеризации используется в производстве поли изобутилена [-СН2-С(СН3)2-]n, полиформальдегида [-СН2О-]n, полиамидов, например поли-ε-капроамида (капрона) [-NH-(СН2)5-СО-]n, синтетических каучуков, например бутадиенового каучука [-СН2-СН=СН-СН2-]n.
Методом полимеризации получают 3/4 всего объема выпускаемых полимеров. Полимеризацию проводят в массе, растворе, эмульсии суспензии или газовой фазе.
Полимеризация в массе (в блоке) - это полимеризация жидкого мономера (мономеров) в неразбавленном состоянии. При этом получают достаточно чистый полимер. Основная сложность проведения процесса связана с отводом теплоты. При полимеризации в растворе мономер растворен в растворителе. При таком способе полимеризации легче отводить теплоту и регулировать состав и структуру полимеров, однако возникает задача удаления растворителя.
Эмульсионная полимеризация (полимеризация в эмульсии) заключается в полимеризации мономера, диспергированного в воде. Для стабилизации эмульсии в среду вводят поверхностно-активные вещества. Достоинство способа - легкость отвода теплоты, возможность получения полимеров с большой молекулярной массой и высокая скорость реакции, недостаток - необходимость отмывки полимера от эмульгатора. Способ широко применяется в промышленности для получения каучуков, полистирола, поливинилхлорида, поливинилацетата, полиметилакрилата и др.
При суспензионной полимеризации (полимеризации в суспензии) мономер находится в виде капель, диспрегированных в воде или другой жидкости. В результате реакции образуются полимерные гранулы размером от 10–6 до 10–3 м. Недостаток метода - необходимость стабилизации суспензии и отмывки полимеров от стабилизаторов.
При газовой полимеризации мономер находится в газовой фазе, а полимерные продукты - в жидком или твердом состоянии. Метод применятся для получения полипропилена и других полимеров.
Поликонденсация. Реакция синтеза полимера из соединений, имеющих две или более функциональные группы, сопровождающаяся образованием низкомолекулярных продуктов (Н2О, NНз, НС1, СН2О и др.), называется поликонденсацией. Существенный вклад в изучении процессов поликонденсации внесли российские ученые В.Коршак, Г.Петров и другие, из зарубежных ученых - У.Карозерс, П.Флори, П.Морган и др. Поликонденсация бифункциональных соединений получила название линейной, например:
