
- •Курс лекций по общей химии
- •Содержание тем:
- •1. Химия и экология
- •Охрана воздушного бассейна
- •2.Строение атома
- •2.1. Квантовые числа
- •2.2. Принцип Паули
- •2.3. Принцип наименьшей энергии
- •2.4. Правило Хунда
- •2.5. Изображение электронного строения атома
- •Контрольные варианты
- •3. Периодическая система элементов д. И. Менделеева
- •Периодические свойства элементов
- •4. Химическая связь
- •4.1. Свойства ковалентной связи
- •4.2. Гибридизация атомных орбиталей
- •4.3. Полярные и неполярные молекулы
- •4.4. Металлическая связь
- •5.Энергетика химических процессов
- •6.Химическая кинетика.
- •7.Химическое равновесие.
- •Вопросы для самоконтроля по теме: «Закономерности протекания химических реакций»
- •Задачи по теме:
- •8.1. Способы выражения концентрации растворов
- •8.2. Примеры решения задач
- •8.2.1. Вычисления количеств компонентов раствора
- •322 Г Na2so4 × 10 h2o содержат - 142 г Na2so4
- •8.2.2. Вычисления при приготовлении разбавленных растворов из концентрированных
- •8.2.3. Вычисления при смешивании растворов
- •8.2.4. Пересчет концентрации из одной формы выражения в другую
- •8.2.5. Вычисления при химических реакциях
- •Контрольные вопросы и задачи
- •9.Свойства разбавленных растворов неэлектролитов
- •I закон Рауля:
- •II закон Рауля:
- •10. Растворы электролитов
- •11. Ионномолекулярные уравнения
- •12. Произведение растворимости
- •13. Ионное произведение воды. Водородный показатель.
- •14. Гидролиз солей
- •15. Дисперсные системы
- •16.1.Классификация дисперсных систем. Получение. Свойства и структура коллоидных систем
- •Методы получения дисперсных систем.
- •16. Химическая идентификация и анализ вещества
- •16.1. Химическая идентификация и анализ вещества
- •Вопросы и задачи для самоконтроля
- •16.2. Количественный анализ. Химические методы анализа
- •Вопросы и задачи для самоконтроля
- •16.3. Инструментальные методы анализа
- •Вопросы и задачи для самоконтроля
- •17. Окислительно-восстановительные реакции (овр)
- •Порядок нахождения степени окисления:
- •Ионно-электронный метод
- •18. Электрохимические процессы
- •18.1. Электродный потенциал
- •18.2. Гальванический элемент Даниэля – Якоби
- •18.3. Электродвижущая сила элемента (эдс)
- •18.4. Потенциалы металлических и газовых электродов
- •Ряд напряжений металлов:
- •19.Электролиз
- •Примеры
- •Электролиз с нерастворимым анодом водного раствора Na2so4:
- •20. Коррозия и защита металлов
- •20.1. Защита от коррозии. Металлические покрытия
- •21. Общие свойства металлов
- •21.1. Физические свойства металлов
- •21.2. Химические свойства металлов Отношение металлов к кислороду воздуха
- •Отношение металлов к воде
- •Это обусловлено наличием на поверхности алюминия очень плотного тонкого слоя химически инертной оксидной пленки, которая ни при каких условиях не взаимодействует с водой.
- •Отношение металлов к растворам кислот
- •А потенциал электродного процесса
- •Отношение некоторых металлов к кислотам
- •Отношение металлов к растворам щелочей
- •Электронные процессы
- •Отношение некоторых металлов к водным растворам щелочей
- •Отношение металлов к растворам солей
- •21.3. Природные соединения металлов
- •Контрольные вопросы
- •22.Жесткость и умягчение воды
- •Контрольные вопросы и задачи
- •23.Определение качественного состава природных вод
- •Общее содержание меди в земной коре сравнительно невелико, однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
- •Некоторые свойства меди и ее аналогов
- •25. Ощая характеристика металлов 2 группы побочной подгруппы. Цинк
- •Некоторые свойства элементов побочной подгруппы
- •Контрольные вопросы
- •26. Общая характеристика металлов побочной подгруппы VI группы. Хром.
- •Хром 5224 Сr
- •27. Общая характеристика металлов побочной подгруппы
- •VII группы.Марганец.
- •Марганец 55 25Мп
- •Соединения марганца
- •Вопросы и задачи:
- •28. Железо 56 26Fe.
- •Соединения железа
- •29. Общая характеристика р-металлов
- •111 Группы побочной подгруппы. Алюминий.
- •Контрольные вопросы.
- •30. Общая характеристика р-металлов 4 группы побочной подгруппы. Олово, свинец.
- •Контрольные вопросы
- •31.Комплексные соединения.
- •31.1.Основные положения координационной теории
- •31.2 Номенклатура комплексных соединений
- •31.3.Устойчивость комплексных соединений
- •Классификация неорганических соединений
- •Классификация неорганических соединений
- •32.1. Оксиды. Номенклатура, классификация оксидов
- •32.2. Получение оксидов и их свойства. Основные, кислотные и амфотерные оксиды
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.3. Гидроксиды (основания). Номенклатура, классификация гидроксидов
- •32.4. Свойства оснований
- •32.5. Понятие об амфотерных гидроксидах
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •Кислоты. Классификация, номенклатура кислот
- •32.7. Свойства кислот
- •Формулы и названия важнейших кислот и их солей
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.8.Соли. Классификация солей
- •33. Органические полимерные материалы
- •33.1. Методы получения полимеров
- •2Nh2-(сн2)5-соон →
- •Вопросы для самоконтроля
- •33.2. Строение полимеров
- •Вопросы для самоконтроля
- •33.3. Свойства полимеров
- •Вопросы для самоконтроля
- •33.4. Применение полимеров
- •Вопросы для самоконтроля
18.4. Потенциалы металлических и газовых электродов
eг.э. = jк - ja , где
jк – потенциал положительного электрода (в элементе катод);
ja – потенциал отрицательного электрода (в элементе анод).
Если потенциал одного из электродов принять равным 0, то относительный потенциал второго электрода будет равен ЭДС элемента.
Т аким
образом можно определить относительный
потенциал любого электрода.
аким
образом можно определить относительный
потенциал любого электрода.
Рис.16. Водородный электрод |
Равновесие на водородном электроде:
2H+ + 2℮ = H2.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, слева – водородный электрод, справа – измеряемый электрод:
H2, Pt | H+ || Меn+ | Ме
eг.э. = jп - jл .
Т.к. jл = 0 => eг.э.= jп = jМеn+/ Ме.
Используем уравнение (5):

RT
jМеn+/ Ме = j0Меn+/ Ме + ∙lnaМеn+ —
nF
уравнение Нернста для потенциала металлического электрода.
При Т = 298К, подставляя значения R и F, получаем
 0,059
0,059
 jМеn+/
Ме =
j0Меn+/
Ме +
∙lgaМеn+
jМеn+/
Ме =
j0Меn+/
Ме +
∙lgaМеn+
n
Для разбавленных растворов a » c.
j0Меn+/ Ме – стандартный потенциал металлического электрода.
Стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с активностью их, равной 1.
Ряд напряжений металлов:
Li |
Rb |
K |
Ba |
Sr |
Ca |
Na |
Mg |
Al |
Mn |
Zn |
Cr |
Fe |
|
-3.02 |
-2.99 |
-2.92 |
-2.90 |
-2.89 |
-2.87 |
-2.71 |
-2.34 |
-1.67 |
-1.05 |
-0.76 |
-0.71 |
-0.44 |
|
Cd |
Co |
Ni |
Sn |
Pb |
H |
Sb |
Bi |
Cu |
Hg |
Ag |
Pd
|
Pt |
Au |
-0.40 |
-0.29 |
-0.25 |
-0.14 |
-0.13 |
0.0 |
+0.20 |
+0.23 |
+0.24 |
+0.79 |
+0.80 |
+0.83 |
+1.20 |
+1.42 |
Водородный электрод: H2, Pt | H+
2H+ + 2℮ = H2. 0,059 a2H+
П ри Т = 298К уравнение Нернста: j2H+/H2 = ∙ lg
2 PH2
Учитывая, что lg aH+ = -pH => j2H+/H2 = -0.0295∙lg PH2 – 0.059pH.
Если PH2 = 1,

j2H+/H2 = -0,059PH
Кислородный электрод: O2, Pt | OH-
O2 + 2H2O +4℮ = 4OH-
При Т=298К уравнение Нернста:
0,059 PO2 ∙a2H2O
j О2/ОH- = jоО2/ОH- + ∙ lg
4 а4ОН-
0,059
Т .к. aH2О = const, то значение ∙lg a2H2O
4
введем в joO2/OH-:
PO2
jO2/OH- = joO2/OH- + 0,0147∙ lg , где
a4OH-
jоО2/ОH- - стандартный потенциал кислородного электрода, равный 0,401 В.
KH2O
У читывая аOH- = и lg aH+ = -PH, получаем
aH+
jО2/ОH- = 1,23 + 0,0147∙lgPO2 – 0,059PH

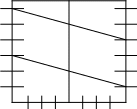
Если PO2 = 1, то jО2/ОH- = 1,23 – 0,059РН (рис.17).
jО2/ОH-
+0,8 +0,8
+0,4 +0,4
0 0
j2H+/H2
-0,8 7 - 0,8
2 4 6 8 10 12 РН
Рис.17. Зависимость потенциалов водородного и кислородного электродов от РН среды при РН2 = 1 и РО2=1 (101 кПа)
