
- •Курс лекций по общей химии
- •Содержание тем:
- •1. Химия и экология
- •Охрана воздушного бассейна
- •2.Строение атома
- •2.1. Квантовые числа
- •2.2. Принцип Паули
- •2.3. Принцип наименьшей энергии
- •2.4. Правило Хунда
- •2.5. Изображение электронного строения атома
- •Контрольные варианты
- •3. Периодическая система элементов д. И. Менделеева
- •Периодические свойства элементов
- •4. Химическая связь
- •4.1. Свойства ковалентной связи
- •4.2. Гибридизация атомных орбиталей
- •4.3. Полярные и неполярные молекулы
- •4.4. Металлическая связь
- •5.Энергетика химических процессов
- •6.Химическая кинетика.
- •7.Химическое равновесие.
- •Вопросы для самоконтроля по теме: «Закономерности протекания химических реакций»
- •Задачи по теме:
- •8.1. Способы выражения концентрации растворов
- •8.2. Примеры решения задач
- •8.2.1. Вычисления количеств компонентов раствора
- •322 Г Na2so4 × 10 h2o содержат - 142 г Na2so4
- •8.2.2. Вычисления при приготовлении разбавленных растворов из концентрированных
- •8.2.3. Вычисления при смешивании растворов
- •8.2.4. Пересчет концентрации из одной формы выражения в другую
- •8.2.5. Вычисления при химических реакциях
- •Контрольные вопросы и задачи
- •9.Свойства разбавленных растворов неэлектролитов
- •I закон Рауля:
- •II закон Рауля:
- •10. Растворы электролитов
- •11. Ионномолекулярные уравнения
- •12. Произведение растворимости
- •13. Ионное произведение воды. Водородный показатель.
- •14. Гидролиз солей
- •15. Дисперсные системы
- •16.1.Классификация дисперсных систем. Получение. Свойства и структура коллоидных систем
- •Методы получения дисперсных систем.
- •16. Химическая идентификация и анализ вещества
- •16.1. Химическая идентификация и анализ вещества
- •Вопросы и задачи для самоконтроля
- •16.2. Количественный анализ. Химические методы анализа
- •Вопросы и задачи для самоконтроля
- •16.3. Инструментальные методы анализа
- •Вопросы и задачи для самоконтроля
- •17. Окислительно-восстановительные реакции (овр)
- •Порядок нахождения степени окисления:
- •Ионно-электронный метод
- •18. Электрохимические процессы
- •18.1. Электродный потенциал
- •18.2. Гальванический элемент Даниэля – Якоби
- •18.3. Электродвижущая сила элемента (эдс)
- •18.4. Потенциалы металлических и газовых электродов
- •Ряд напряжений металлов:
- •19.Электролиз
- •Примеры
- •Электролиз с нерастворимым анодом водного раствора Na2so4:
- •20. Коррозия и защита металлов
- •20.1. Защита от коррозии. Металлические покрытия
- •21. Общие свойства металлов
- •21.1. Физические свойства металлов
- •21.2. Химические свойства металлов Отношение металлов к кислороду воздуха
- •Отношение металлов к воде
- •Это обусловлено наличием на поверхности алюминия очень плотного тонкого слоя химически инертной оксидной пленки, которая ни при каких условиях не взаимодействует с водой.
- •Отношение металлов к растворам кислот
- •А потенциал электродного процесса
- •Отношение некоторых металлов к кислотам
- •Отношение металлов к растворам щелочей
- •Электронные процессы
- •Отношение некоторых металлов к водным растворам щелочей
- •Отношение металлов к растворам солей
- •21.3. Природные соединения металлов
- •Контрольные вопросы
- •22.Жесткость и умягчение воды
- •Контрольные вопросы и задачи
- •23.Определение качественного состава природных вод
- •Общее содержание меди в земной коре сравнительно невелико, однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
- •Некоторые свойства меди и ее аналогов
- •25. Ощая характеристика металлов 2 группы побочной подгруппы. Цинк
- •Некоторые свойства элементов побочной подгруппы
- •Контрольные вопросы
- •26. Общая характеристика металлов побочной подгруппы VI группы. Хром.
- •Хром 5224 Сr
- •27. Общая характеристика металлов побочной подгруппы
- •VII группы.Марганец.
- •Марганец 55 25Мп
- •Соединения марганца
- •Вопросы и задачи:
- •28. Железо 56 26Fe.
- •Соединения железа
- •29. Общая характеристика р-металлов
- •111 Группы побочной подгруппы. Алюминий.
- •Контрольные вопросы.
- •30. Общая характеристика р-металлов 4 группы побочной подгруппы. Олово, свинец.
- •Контрольные вопросы
- •31.Комплексные соединения.
- •31.1.Основные положения координационной теории
- •31.2 Номенклатура комплексных соединений
- •31.3.Устойчивость комплексных соединений
- •Классификация неорганических соединений
- •Классификация неорганических соединений
- •32.1. Оксиды. Номенклатура, классификация оксидов
- •32.2. Получение оксидов и их свойства. Основные, кислотные и амфотерные оксиды
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.3. Гидроксиды (основания). Номенклатура, классификация гидроксидов
- •32.4. Свойства оснований
- •32.5. Понятие об амфотерных гидроксидах
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •Кислоты. Классификация, номенклатура кислот
- •32.7. Свойства кислот
- •Формулы и названия важнейших кислот и их солей
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.8.Соли. Классификация солей
- •33. Органические полимерные материалы
- •33.1. Методы получения полимеров
- •2Nh2-(сн2)5-соон →
- •Вопросы для самоконтроля
- •33.2. Строение полимеров
- •Вопросы для самоконтроля
- •33.3. Свойства полимеров
- •Вопросы для самоконтроля
- •33.4. Применение полимеров
- •Вопросы для самоконтроля
12. Произведение растворимости
CaSO4 = Ca2+ + SO2-4
твердая ионы в растворе
соль
[Ca2+] × [SO2-4]
 Кравн.
=
Кравн.
=
[CaSO4]
[CaSO4] – const => Kравн. × [CaSO4] = К¢ => K¢ = [Ca2+] × [SO2-4] или

ÕР = [Ca2+] × [SO2-4] - произведение растворимости
электролита.
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре.
13. Ионное произведение воды. Водородный показатель.
H2O = H+ + OH-
Кдис. = [H+] × [OH-] / [H2O]
[H2O] = const, поскольку степень диссоциации воды очень мала.
[H2O] × Кдис = КH2O или

КH2O = [H+] × [OH-] - ионное произведение воды.
Для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид – ионов есть величина постоянная.
В чистой воде при t = 25°С:
[H+] = [OH-] = 10-7 моль/л =>
КH2O = 10-7 × 10-7 = 10-14
Растворы, в которых концентрации ионов водорода и гидроксид – ионов одинаковы, называются нейтральными растворами.
Если [H+] = 10-5 моль/л =>
[OH-] = КH2O / [H+] = 10-14 / 10-5 = 10-9 моль / л.
Нейтральный раствор: [H+] = 10-7 моль / л;
Кислый раствор: [H+] > 10-7 моль / л;
Щелочной раствор: [H+] < 10-7 моль /л.

PH = -lg [H+] - водородный показатель.
Если [H+] = 10-5 моль /л, то PH = -lg10-5 = 5.
Если [H+] = 10-7 моль /л, то PH = -lg10-7 = 7 – нейтральный раствор.
Если PH < 7 – кислый раствор,
PH > 7 – щелочной раствор.
POH = - lg[OH-] – гидроксильный показатель.
PH + POH = 14 при t=25°С.
14. Гидролиз солей
Гидролиз – взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой.
N aCl
+ H2O
®
aCl
+ H2O
®
HCl + NaOH ® NaCl + H2O
H + + Cl- + Na+ + OH- ® Na+ + Cl- + H2O
H+ +OH- ® H2O
Гидролизу подвергаются соли:
а) образованные сильным основанием и слабой кислотой.
Рассмотрим случай со слабой одноосновной кислотой:
CH3COONa + H2O = CH3COOH + NaOH
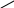 CH3COO-
+ Na+
+ H2O
= CH3COOH
+ Na+
+ OH-
CH3COO-
+ Na+
+ H2O
= CH3COOH
+ Na+
+ OH-
CH3COO- + H2O = CH3COOH + OH-, Ph > 7, среда щелочная.
Рассмотрим случай со слабой многоосновной кислотой,
(кислота двухосновная – H2CO3) – ступенчатый гидролиз:
I ступень: Na2CO3 + H2O = NaHCO3 + NaOH
кислая соль
2Na+ + CO2-3 + H2O = Na+ + HCO-3 + Na+ + OH-
CO2-3 + H2O = HCO-3 + OH-
II ступень: NaHCO3 + H2O = H2CO3 + NaOH
Na+ + HCO-3 + H2O = H2CO3 + Na+ + OH-
HCO-3 + H2O = H2CO3 + OH- , Ph > 7, среда щелочная.
Гидролиз идет по аниону;
б) образованные сильной кислотой и слабым основанием.
Рассмотрим случай с основанием одновалентного металла:
NH4Cl + H2O = NH4OH + HCl
NH+4 + Cl- + H2O = NH4OH + H+ + Cl-
NH+4 + H2O = NH4OH + H+ , Ph < 7, среда кислая.
Рассмотрим случай с основанием многовалентного металла
(основание двухвалентного металла – Cu(OH)2) – ступенчатый гидролиз:
I ступень: CuCl2 +H2O = CuOHCl +HCl
основная соль
Cu2+ + 2Cl- +H2O = CuOH+ + Cl- +H+ + Cl-
Cu2+ + H2O = CuOH+ +H+ ,
II ступень: CuOHCl + H2O = Cu(OH)2 + HCl
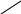 CuOH+
+ Cl-
+ H2O
= Cu(OH)2
+ H+
+ Cl-
CuOH+
+ Cl-
+ H2O
= Cu(OH)2
+ H+
+ Cl-
CuOH+ + H2O = Cu(OH)2 + H+ , Ph < 7, среда кислая.
Гидролиз идет по катиону;
в) образованные слабым основанием и слабой кислотой:
NH4CH3COO + H2O = NH4OH + CH3COOH
NH+4 + CH3COO- + H2O = NH4OH + CH3COOH
NH+4 + H2O = NH4OH +H+
CH3COO- + H2O = CH3COOH + OH-
Гидролиз идет и по катиону, и по аниону.
Ph » 7, среда близка к нейтральной.
