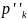- •«Расчет химического равновесия»
- •Условия расчета
- •Выбор термодинамических свойств веществ
- •Расчет изменения теплоемкости в ходе химической реакции
- •Расчет и построение графической зависимости стандартного теплового эффекта реакции от температуры
- •Расчет зависимости константы равновесия от температуры
- •Расчет изменений стандартной энергии Гиббса и стандартной энтропии реакции
- •Расчет парциальных давлений компонентов при заданном начальном составе смеси
- •Определение направления процесса при заданных условиях
- •Определение влияния давления на смещение равновесия
- •Определение равновесных парциальных давлений
Расчет парциальных давлений компонентов при заданном начальном составе смеси
По заданным начальным значениям количества вещества (моль): n1, n2 и т.д. и общему давлению р′общ рассчитаем начальные парциальные давления участвующих в реакции газов: p′k = хk р′ общ, где хk - мольная доля компонента газовой смеси.
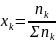 ;
Σ
nk
= 8,7 , тогда
;
Σ
nk
= 8,7 , тогда
xC3H8
=
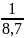 = 0,114942529
= 0,114942529
xC3H6
=
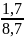 = 0,195402299
= 0,195402299
xH2
=
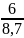 = 0,689655172
= 0,689655172
Рассчитаем парциальное давление компонентов по формуле:
pk = xk×робщ
p′k(C3H8) = 0,114942529×0,3 = 0,034482759
p′k(C3H6) = 0,195402299×0,3 = 0,05862069
p′k(H2) = 0,689655172×0,3 = 0,206896552
Далее, используя значения мольных долей компонентов, рассчитываем парциальные давления p′′k участников реакции при измененном в М = 20 раз общем давлении. Полученные данные внесём в Таблицу №3.
Таблица №3
Вещество |
моль |
|
атм
|
атм
|
атм |
атм
|
|
1 |
0,114942529 |
0,3 |
0,034482759 |
6 |
0,68965517 |
|
1,7 |
0,195402299 |
0,3 |
0,05862069 |
6 |
1,17241379 |
|
6 |
0,689655172 |
0,3 |
0,206896552 |
6 |
4,13793103 |
Определение направления процесса при заданных условиях
Расчет ∆GT проводится по уравнению изотермы химической реакции. Одна из форм записи этого уравнения для нашей реакции имеет вид:
∆G975
= - RT lnKP,975
+ RT ln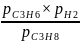
Рассчитаем ∆G975 при р′общ = 0,3атм и Т = 975К. Полученное значение ∆G′975 = -14384,90945 Дж/моль указывает на то, что при выбранных условиях реакция может идти самопроизвольно в сторону образования продуктов.
Определение влияния давления на смещение равновесия
Для определения влияния давления на смещение равновесия рассчитаем ∆rG″975 при р′′общ = 6 атм, Т = 975К и том же соотношении компонентов. Получим ∆rG″975 = 9898,945716 Дж/моль.
Сравнив полученные значения ∆rG′975 и ∆rG″975 , видим, что увеличение давления приводит к возрастанию энергии Гиббса и, следовательно, к смещению равновесия в сторону реагентов.
Определение равновесных парциальных давлений
Рассчитаем равновесные парциальные давления в атм. для всех участников реакции при рабочей температуре (975 К) и рабочем давлении (0,3 атм). Если мольные доли и парциальные давления всех компонентов в равновесном состоянии:
Σ n∗k = 21,25 + α, тогда
xC3H8
=
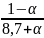 ,
,
xC3H6
=
 ,
,
xH2
=
 .
.
pC3H8 = pобщ,
pC3H6 = pобщ,
pH2 = pобщ.
Запишем уравнение для константы равновесия через равновесные парциальные давления:
KP,975
= 2,074 =

Из
полученного уравнения, с помощью функции
exel
«поиск решения» находим
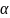 = 0,747227628
= 0,747227628
Рассчитываем равновесные парциальные давления компонентов:
p*C3H8 = 0,008026875, p*C3H6 = 0,077712565, p*H2 = 0,214260561.
Чтобы убедиться в правильности расчета, подставим полученные значения равновесных парциальных давлений в выражение константы равновесия и вычислим ее :
KP
=
 = 2,074373716
= 2,074373716
что достаточно хорошо согласуется с расчетами константы равновесия по уравнению Вант-Гоффа (см табл. 2).




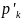
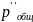 =
=