
31-60
.docxДалее к атому азота последовательно присоединяются все остальные компоненты пуринового ядра. Первым продуктом биосинтеза, содержащим готовую пуриновую структуру, является инозинмонофосфат (ИМФ). В его состав входит азотистое основание гипоксантин.
ИМФ является предшественником аденилового и гуанилового нуклеотидов. В синтезе АМФ из ИМФ при взаимодействии аспартатом образуется аденилосукцинат. В следующей реакции отщепляется фумарат и образуется АМФ.

Образование АМФ и ГМФ из инозинмонофосфата.
Синтез ГМФ из ИМФ также включает две стадии. Сначала ИМФ окисляется в ксантозинмонофосфат, затем добавляется NH2-группа из глутамина.
Интересно отметить, что синтез АМФ требует участия ГТФ, а синтез ГМФ – участия АТФ. Эта особенность биосинтеза способствует поддержанию нужного соотношения адениловых и гуаниловых нуклеотидов в клетке.
Наряду с биосинтезом пуриновых нуклеотидов в клетке de novo существуют пути регенерации пуриновых нуклеотидов из свободных азотистых оснований, образующихся при гидролизе нуклеиновых кислот и нуклеотидов. Эти реакции проще, чем пути синтеза нуклеотидов de novo, и энергетическая цена их значительно меньше. Наибольшее значение имеет механизм фосфорибозилирования пуриновых оснований.
В клетках имеются 2 фермента, участвующих в реакциях синтеза нуклеотидов из пуриновых оснований.
Аденин-фосфорибозилтрансфераза (АФРТ) катализирует перенос фосфорибозы с ФРПФ на аденин:
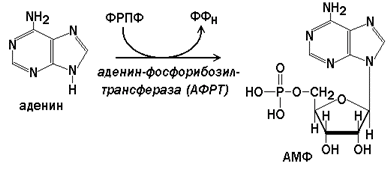
Гипоксантин-гуанин-фосфорибозилтрансфераза(ГГФРТ) катализирует перенос фосфорибозы с ФРПФ на гуанин или гипоксантин:


Реакции с участием второго фермента протекают более активно, чем синтез АМФ из аденина.
Нарушения обмена пуриновых нуклеотидов. При нарушениях пуринового обмена часто наблюдается гиперурикемия – повышение содержания мочевой кислоты в крови. Гиперурикемия может быть первичной или вторичной.
Первичная гиперурикемия является ведущим симптомом подагры – полиэтиологического заболевания, как правило, наследственной природы. Гиперурикемия при подагре обусловлена главным образом, избыточным образованием образованием мочевой кислоты, а также снижением её экскреции с мочой. Значительная и длительная гиперурикемия сопровождается отложением солей мочевой кислоты в хрящевой ткани, сухожилиях и слизистых сумках суставов. Накопление кристаллов уратов в тканях может вызывать резкую воспалительную реакцию (подагрический артрит), что приводит впоследствии к деформации сустава. Избыток мочевой кислоты способствует также образованию уратных камней в нижних отделах мочевыводящих путей.
Повышение уровня мочевой кислоты в крови отмечается также при наследственных дефектах некоторых ферментов:
Синдром Леша-Нихана (полное отсутствие ГГФРТ) наследуется как сцепленный с Х-хромосомой рецессивный признак. Болезнь характеризуется параличом, сопровождающимся судорогами, стремлением к членовредительству и тяжёлой гиперурикемией. Вследствие ферментативного дефекта нарушается переход гуанина и гипоксантина в ГМФ и ИМФ соответственно и указанные пуриновые основания превращаются в мочевую кислоту. Кроме того, повышенная концентрация ФРПФ способствует усилению синтеза пуринов de novo. Биохимическая основа неврологических отклонений при синдроме Леша-Нихана неизвестна.
Гликогеноз I типа или болезнь Гирке (дефицит глюкозо-6-фосфатазы) сопровождается повышением активности пентозофосфатного пути и приводит к повышению внутриклеточного уровня рибозо-5-фосфата, из которого синтезируется ФРПФ. Повышенный уровень ФРПФ приводит к увеличению синтеза пуринов de novo. Для данного заболевания характерен также лактатный ацидоз, приводящий к повышению порога секреции уратов почками; это способствует накоплению уратов в организме.
Вторичная гиперурикемия сопутствует заболеваниям, сопровождающимся усиленным распадом клеток (лейкозы, серповидно-клеточная анемия, сахарный диабет, псориаз).
Реже встречается гипоурикемия – снижение содержания мочевой кислоты в крови. Она может быть связана с понижением реабсорбции уратов из клубочкового фильтрата в почках. В этом случае наблюдается увеличение экскреции мочевой кислоты с мочой.
Гипоурикемия развивается и при недостаточности ксантиноксидазы, возникающей при генетическом дефекте фермента или при тяжёлом поражении печени. Это состояние сопровождается повышенной экскрецией гипоксантина и ксантина (ксантинурией), а также образованием в почках ксантиновых камней.
Структура пиримидинового ядра проще, чем структура пуринового, и путь биосинтеза его короче.
Главное отличие от биосинтеза пуринов заключается в том, что сборка пиримидинового ядра не требует участия фосфорибозилпирофосфата (ФРПФ). Пиримидиновая структура сначала образуется, а потом взаимодействует с ФРПФ с образованием нуклеотидов.
Предшественниками атомов углерода и азота пиримидинового кольца являются СО2 и аминокислоты глутамин и аспартат .
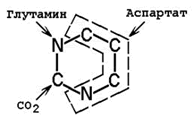
Происхождение атомов пиримидинового ядра.
При взаимодействии СО2 и глутамина образуется карбамоилфосфат. Реакция протекает в цитозоле с затратой АТФ.

Следует напомнить, что карбамоилфосфат также образуется в процессе синтеза мочевины, но эта реакция происходит только в митохондриях печени и катализируется другим ферментом.
Карбамоилфосфатсинтетаза, участвующая в биосинтезе пиримидинов, - аллостерический фермент, он ингибируется УТФ, пуриновыми нуклеотидами, активируется ФРПФ.
Следующая реакция биосинтеза пиримидинов – образование карбамоиласпартата. Реакцию катализирует аспартат-транскарбамоилаза (АТК-аза).

АТК-аза – аллостерический фермент, его ингибитором является цитидинтрифосфат (ЦТФ) – конечный продукт биосинтеза пиримидиновых нуклеотидов.

Схема синтеза пиримидиновых нуклеотидов.
Нуклеотиды, которые образуются при гидролизе РНК и ДНК, распадаются внутриклеточно.
Нуклеотидазы удаляют фосфат из 5’-положения у пуриновых и пиримидиновых рибо- и дезоксирибонуклеотидов, превращая их таким образом в рибо- и дезоксирибонуклеозиды.

Схема катаболизма пуриновых нуклеотидов в тканях представлена на рисунке 27.2.

Катаболизм пуриновых нуклеотидов.
Аденозинмонофосфат (АМФ) подвергается гидролизу с образованием аденозина, последний подвергается дезаминированию и превращается в инозин;
Гуанозинмонофосфат (ГМФ) подвергается гидролизу с образованием гуанозина.
Нуклеозидфосфорилазы катализируют фосфоролиз нуклеозидов с образованием свободных оснований и рибозо-1-фосфата или дезоксирибозо-1-фосфата. При фосфоролизе разрывается N-гликозидная связь при взаимодействии с неорганическим фосфатом.
Конечным продуктом распада пуринов является мочевая кислота, которая образуется следующим путём.
Гипоксантин, продукт распада АМФ, окисляется до ксантина ферментом ксантиноксидазой.
Гуанин, продукт распада ГМФ, дезаминируется с образованием ксантина.
Ксантин окисляется ксантиноксидазой до мочевой кислоты. В реакции окисления с участием ксантиноксидазы используется кислород (О2) и образуется пероксид водорода (Н2О2). Ксантиноксидаза содержит молибден, поэтому этот элемент необходим человеку в небольших количествах. Фермент также содержит железо и серу.
Мочевая кислота и её соли (ураты) плохо растворимы в воде, поэтому в крови они транспортируются частично в комплексе с уратсвязывающим белком. Содержание мочевой кислоты в сыворотке крови здоровых людей составляет 0,24-0,59 ммоль/л у мужчин и 0,16-0,40 ммоль/л у женщин.
Урат натрия легко фильтруется почечными клубочками млекопитающих, интенсивно реабсорбируется в проксимальных канальцах, затем секретируется в петле Генле и, вероятно, снова реабсорбируется в дистальных канальцах. За сутки здоровым человеком выделяется 400 – 600 мг мочевой кислоты. Большое количество фармакологических препаратов и природных соединений оказывает влияние на реабсорбцию урата натрия в почечных канальцах и его экскрецию. Аспирин в больших дозах ингибирует как экскрецию, так и реабсорбцию мочевой кислоты в почках.
Схема катаболизма пиримидиновых нуклеотидов в тканях

Цитидинмонофосфат (ЦМФ) подвергается гидролизу с образованием цитидина, последний вступает в реакцию дезаминирования и переходит в уридин.
Уридинмонофосфат (УМФ) подвергается гидролизу с образованием уридина.
Тимидинмонофосфат (ТМФ) подвергается гидролизу с образованием тимидина.
Нуклеозидфосфорилазы катализируют фосфоролиз нуклеозидов с образованием свободных оснований и рибозо-1-фосфата или дезоксирибозо-1-фосфата. При фосфоролизе разрывается N-гликозидная связь при взаимодействии с неорганическим фосфатом.
Нуклеозидфосфорилазы легко катализируют и обратные превращения свободных оснований в нуклеозиды. Обратные реакции важны для путей реутилизации оснований, особенно урацила и тимина.
Конечными продуктами распада пиримидинов являются β-аланин (образуется из урацила) и β-аминоизобутират (из тимина), которые выводятся с мочой. β-Аланин может служить источником для синтеза коэнзима А, а также ансерина и карнозина – компонентов мышечной ткани.
47.
РНК (рибонуклеиновая кислота) содержится преимущественно в цитоплазме клетки и имеет молекулярную массу в пределах 104 - 106 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, урацил, углевод рибоза и остатки фосфорной кислоты. В отличие от ДНК, молекулы РНК построены из одной полинуклеотидной цепи, в которой могут находиться комплементарные друг другу участки. Эти участки могут взаимодействовать между собой, образуя двойные спирали, чередующиеся с неспирализованными участками.

Схема строения транспортной РНК.
По особенностям структуры и функции различают три основных типа РНК:
1) матричные (информационные) РНК (мРНК) передают информацию о структуре белка из клеточного ядра на рибосомы;
2) транспортные РНК (тРНК) осуществляют транспорт аминокислот к месту синтеза белка;
3) рибосомальные РНК (рРНК) входят в состав рибосом, участвуют в синтезе белка.
Первичной структурой нуклеиновых кислот называется последовательность расположения мононуклеотидов в цепи ДНК или РНК. Первичная структура нуклеиновых кислот стабилизируется 3',5'-фосфодиэфирными связями. Эти связи образуются при взаимодействии гидроксильной группы в 3'-положении пентозного остатка каждого нуклеотида с фосфатной группой соседнего нуклеотида,
Таким образом, на одном конце полинуклеотидной цепи имеется свободная 5'-фосфатная группа (5'-конец), а на другом - свободная гидроксильная группа в 3'-положении (3'-конец). Нуклеотидные последовательности принято записывать в направлении от 5'-конца к 3'-концу.
Вторичная структура. Молекулы РНК представляют собой единичные полинуклеотидные цепи. Отдельные участки молекулы РНК могут соединяться и образовывать двойные спирали. По своей структуре спирали РНК похожи на А-форму ДНК. Однако часто спаривание оснований в таких спиралях бывает неполным, а иногда даже и не уотсон-криковским. В результате внутримолекулярного спаривания оснований формируются такие вторичные структуры, как стебель-петля («шпилька») и псевдоузел[10].
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от «шпильки», расположенной в 3' нетранслируемой области. Псевдоузлы служат для программированного сдвига рамки считывания при трансляции.
Аминокислоты и триплеты нуклеотидов, кодирующие их, не комплементарны друг другу. Поэтому должны существовать молекулы-адапторы, каждая из которых может взаимодействовать как с определённым кодоном, так и с соответствующей аминокислотой. Такими молекулами являются транспортные РНК (рисунок 8.3). Каждая тРНК содержит триплет нуклеотидов – антикодон, который комплементарен строго определённому кодону мРНК.
3’-конец тРНК (акцепторный участок) является местом присоединения аминокислоты, соответствующей кодону мРНК.
Синтез белка осуществляется с помощью сложной белоксинтезирующей системы. В ее состав входят следующие компоненты:
1. Рибосомные субъединицы 30S и 50S, которые у прокариот и в митохондриях и хлоропластах эукариот образуют рибосому 70S; или субъединицы 40S и 60S, образующие у эукариот рибосому 80S.
2. Матричная РНК (мРНК).
3. Полный комплект двадцати аминоацил-тРНК, для образования которых необходимы соответствующие аминокислоты, аминоацил-тРНК-синтетазы, тРНК и АТФ. Аминоацил-тРНК (аа-тРНК) - это заряженная энергией и связанная с тРНК аминокислота, готовая для подвоза к рибосоме и включения в синтезирующийся на ней полипептид.
4. Белковые факторы инициации (у прокариот - IF-1, IF-2, IF-3).
5. Белковые факторы элонгации (у прокариот - EF-Tu, EF-Ts, EF-G).
6. Белковые факторы терминации (у прокариот - RF-1, RF-2, RF-3).
7. Некоторые другие белковые факторы (ассоциации, диссоциации субъединиц, высвобождения и пр.).
8. Гуанозинтрифосфат (ГТФ).
9. Неорганические катионы в определенной концентрации.
Основным компонентом белоксинтезирующей системы является рибосома. Она объединяет все компоненты в единый комплекс. Рибосомы — «святая святых» клетки, так как именно на них совершается самое удивительное таинство живой материи — биологический синтез белка. Информация, содержащаяся в геноме, расшифровывается и материализуется в виде белков на рибосомах. Без них проявление жизнедеятельности невозможно.
48.
Репликация – процесс самоудвоения ДНК, или биосинтез дочерней молекулы ДНК, полностью идентичной исходной молекуле (матрице). Локализация процесса – клеточное ядро. Основные принципы репликации ДНК:
-комплементарность - синтезируемые цепи комплементарны матрице;
-антипараллельность - 5'-конец синтезируемой полинуклеотидной цепи находится напротив 3'-конца матрицы и наоборот;
-униполярность - синтез полинуклеотидных цепей происходит всегда в направлении 5' → 3';
-потребность в затравке - ферменты, синтезирующие ДНК, способны лишь наращивать существующую полинуклеотидную цепь, поэтому вначале синтезируется короткая цепь РНК (затравка или праймер), к которой присоединяются дезоксирибонуклеотиды; выполнившая свою роль РНК-затравка удаляется;
-прерывистость - одна из дочерних цепей (лидирующая) в процессе репликации растёт непрерывно, а другая (отстающая) - в виде фрагментов длиной в несколько сот нуклеотидов (фрагментов Оказаки);
-полуконсервативность - в результате репликации образуются две двойные дочерние ДНК, каждая из которых сохраняет (консервирует) в неизменном виде одну из половин материнской ДНК.
Условия, необходимые для репликации ДНК:

1) Матрица – молекула ДНК (а);
2) Расплетающие белки – разрывают водородные связи между комплементарными основаниями двойной спирали ДНК, в результате чего образуется репликативная вилка (б);
3) ДНК-связываюшие белки - присоединяются к разделившимся цепям ДНК и препятствуют их обратному воссоединению;
4) Праймаза (РНК-полимераза) - фермент, синтезирующий затравочную РНК.
5) Субстраты и источники энергии – дезоксирибонуклеозидтрифосфаты (дАТФ, дГТФ, дТТФ, дЦТФ). Присоединяются к азотистым основаниям полинуклеотидных цепей при помощи водородных связей по принципу комплементарности;
6) ДНК-полимераза – фермент, который формирует из нуклеозидтрифосфатов новые полинуклеотидные цепи за счёт образования 3’,5’-фосфодиэфирных связей. Источником энергии служат макроэргические связи нуклеозидтрифосфатов. На одной ветви репликативной вилки синтезируется непрерывная цепь, на другой – фрагменты Оказаки (в);
7) ДНК-лигаза – фермент, соединяющий фрагменты Оказаки в единую цепь (г).
В результате образуются две идентичные молекулы ДНК ( д).
Транскрипция – биосинтез РНК на матрице ДНК. Процесс транскрипции также происходит в клеточном ядре. Основные принципы транскрипции:
-комплементарность - синтезируемые цепи комплементарны матрице;
-антипараллельность - 5'-конец синтезируемой полинуклеотидной цепи находится напротив 3'-конца матрицы и наоборот;
-униполярность - синтез полинуклеотидных цепей происходит всегда в направлении 5' → 3';
-беззатравочность - биосинтез РНК не требует наличия праймера;
-асимметричность - синтез дочерней цепи идёт только на одной цепи ДНК-матрицы, вторая при этом блокирована.
Условия, необходимые для транскрипции:
Матрица – участок одной из цепей ДНК (рисунок 8.2, а);
ДНК-зависимая РНК-полимераза – главный фермент, участвующий в транскрипции. Место присоединения фермента к ДНК – промотор;
Субстраты и источники энергии – рибонуклеозидтрифосфаты (АТФ, ГТФ, УТФ, ЦТФ). Связываются с азотистыми основаниями транскрибируемой цепи ДНК водородными связями по принципу комплементарности.
При участии ДНК-зависимой РНК-полимеразы образуются 3’,5’-фосфодиэфирные связи. Направление полимеризации цепи РНК – от 5’-конца к 3’-концу. Сигналом к окончанию транскрипции служат терминирующие последовательности нуклеотидов (рисунок 8.2,б).
В результате образуются первичные транскрипты – предшественники мРНК, тРНК и рРНК. Затем происходит их посттранскрипционное созревание (процессинг).
Процессинг мРНК включает:
-вырезание неинформативных участков – интронов (в);
-сращивание (сплайсинг) информативных участков – экзонов ( г);
-защиту концевых участков от действия нуклеаз (д):
присоединение 7-метилгуанилата («колпачок») к 5’-концу 5’,5’- фосфодиэфирной связью;
присоединение полиаденилового нуклеотида к 3’-концу.
Образующаяся мРНК поступает из ядра в цитоплазму клеток.
49.
Трансляция (от англ. translation – перевод) – перевод генетической информации, заключённой в мРНК, в линейную последовательность аминокислот в полипептидной цепи. Этот перевод осуществляется посредством генетического (биологического) кода.
Генетический код – последовательность нуклеотидов, соответствующая определённым аминокислотам. Генетический код характеризуется свойствами:
-код триплетный – каждой аминокислоте соответствует тройка (триплет) нуклеотидов – кодон. Всего существует 43 = 64 кодона. Из них 61 является смысловым (то есть кодирует определённую аминокислоту) и 3 – бессмысленными (терминирующими);
-код неперекрывающийся – один и тот же нуклеотид ДНК или РНК не может принадлежать одновременно двум соседним кодонам;
-код непрерывный – отсутствуют «знаки препинания», вставки между кодонами в полинуклеотидной цепи;
-код вырожденный (множественный) – некоторые аминокислоты могут кодироваться более, чем одним триплетом нуклеотидов (так как кодонов 61, а аминокислот – 20);
-код универсальный – смысл кодонов одинаков для организмов всех видов.
Собственно процесс трансляции включает 3 стадии – инициации, элонгации, терминации и происходит на рибосомах.
Каждая рибосома состоит из большой и малой субчастиц (40S и 60S) и содержит аминоацильный (А) и пептидильный (П) участки. Пептидильный участок связывает инициирующую аминоацил-тРНК, все остальные аминоацил-тРНК присоединяются к аминоацильному участку.
Стадии трансляции представлены на рисунке.
1) Стадия инициации – начало трансляции. Условия, необходимые для инициации:
инициирующий кодон мРНК (АУГ);
белковые факторы инициации;
малая и большая субчастицы рибосомы;
ГТФ (источник энергии для смыкания субчастиц рибосомы);
ионы магния;
инициирующая аминоацил-тРНК (метионил-тРНК) – связывается своим антикодоном с инициирующим кодоном мРНК в пептидильном участке рибосомы.
В результате образуется инициирующий комплекс: мРНК – рибосома – метионил-тРНК
2) Стадия элонгации – удлинение полипептидной цепи на 1 аминокислотный остаток – происходит в три шага:
присоединение к инициирующему комплексу аминоацил-тРНК, соответствующей кодону, находящемуся в аминоацильном участке рибосомы транспептидация – образование пептидной связи между остатками аминокислот. Источник энергии – ГТФ;
транслокация – перемещение рибосомы относительно мРНК на 1 триплет. Источник энергии – ГТФ. В ходе элонгации принимают участие белковые факторы.
Описанный процесс многократно повторяется (по количеству аминокислот в цепи).
3) Стадия терминации – окончание трансляции. Обеспечивается присутствием в цепи мРНК одного из терминирующих (бессмысленных) кодонов – УАА, УГА или УАГ. В освобождении полипептида участвуют белковые факторы терминации. Когда в аминоацильном участке оказывается один из бессмысленных кодонов, факторы терминации стимулируют гидролазную активность пептидилтрансферазы. Благодаря этому гидролизуется связь между тРНК и пептидом. ГТФ для этой реакции не требуется. После этого пептидная цепь, тРНК и мРНК покидают рибосому, а её субчастицы диссоциируют.
Таким образом, трансляция мРНК приводит к формированию пептидной цепи со строго определённой последовательностью аминокислотных остатков. Следующий этап формирования белка – фолдинг, т.е. сворачивание пептидной цепи в правильную трёхмерную структуру. Если белок состоит из нескольких субъединиц, то фолдинг включает и объединение их в единую макромолекулу.
Считается, что небольшие белковые молекулы, содержащие около 100 аминоацильных остатков, могут самостоятельно принимать трёхмерную структуру, фолдинг более крупных полипептидных цепей требует участия специальных белков – шаперонов.
Шапероны называют иначе белками теплового шока, так как они не только обеспечивают правильный фолдинг вновь образованных белков, но и ренатурацию ранее синтезированных белков, подвергшихся в клетке частичной денатурации под действием различных факторов (перегрев, облучение, действие своблодных радикалов и т.д.).
Посттрансляционные модификации белковой молекулы могут включать:
-частичный протеолиз (например, превращение профермента в фермент);
-присоединение простетической группы (остатков фосфорной кислоты, углеводных остатков, гемовых групп и т.д.);
-модификации боковых цепей аминокислотных остатков:
-гидроксилирование пролина в гидроксипролин в коллагене,
-метилирование аргинина в гистоне,
-йодирование тирозина в тироглобулине
50.
Оперон (транскриптон) - совокупность генов, способных включаться и выключаться в зависимости от метаболических потребностей клетки. В состав оперона наряду со структурными генами (СГ), кодирующими структуру определённых белков, входят участки ДНК, выполняющие регуляторные функции . Группа структурных генов, отвечающих за синтез ферментов одного метаболического пути, находится под контролем гена-оператора (ГО), расположенного рядом. Функция гена-оператора контролируется пространственно удалённым от него геном-регулятором (ГР), который продуцирует белок-репрессор, находящийся в активной либо в неактивной форме. Активный белок-репрессор способен связываться с геном-оператором и тормозить транскрипцию структурных генов, следовательно, подавлять синтез белков. Вещества, вызывающие инактивацию белка-репрессора, являются индукторами синтеза белка, оказывающие противоположный эффект – корепрессорами. В качестве индукторов могут выступать исходные субстраты метаболических путей, в качестве корепрессоров - конечные продукты этих путей.
Существуют два механизма регуляции синтеза белка – индукция и репрессия. Примером оперона, который регулируется по механизму индукции, является лактозный оперон, в состав которого наряду с геном-оператором входят 3 структурных гена, кодирующие ферменты катаболизма лактозы. Лактоза является индуктором данного оперона. При высокой концентрации лактозы в среде ферменты синтезируются, при низкой концентрации – нет.
По механизму репрессии регулируется гистидиновый оперон, содержащий ген-оператор и 10 структурных генов, кодирующих ферменты, необходимые для биосинтеза гистидина. Гистидин является корепрессором данного оперона. При высокой концентрации гистидина в среде синтез ферментов прекращается, при отсутствии гистидина они синтезируются.
Действие токсических и лекарственных веществ на биосинтез белка. Биосинтез белка является одним из наиболее сложных процессов, протекающих в клетках. Его прерывание или извращение возможно в результате нарушения любого из трёх матричных синтезов.
Так, мутагены (бенз(а)пирен, линдан) нарушают репликацию ДНК и таким образом прерывают белоксинтезирующие процессы.
Некоторые токсические вещества (госсипол) могут изменять скорость транскрипции.
К лекарственным веществам, влияющим на биосинтез белка, относятся антибиотики и интерфероны.
Антибиотики, блокирующие матричные биосинтезы, используются в лечении инфекционных заболеваний и злокачественных опухолей.
Антибиотики, ингибирующие матричные биосинтезы(Антибиотики-Механизм действия)
Противоопухолевые препараты: актиномицин Д, рубомицин С, митомицин С
Подавляют репликацию или транскрипцию, или оба эти процесса
Противобактериальные препараты: тетрациклин, левомицетин, эритромицин, стрептомицин. Ингибируют трансляцию в бактериальных (но не эукариотических) клетках.
51.
52.
Гормоны – биологически активные соединения, выделяемые железами внутренней секреции в кровь или лимфу и оказывающие влияние на метаболизм клетки.
Основные особенности действия гормонов на органы и ткани:
-гормоны синтезируются и выделяются в кровь специализированными эндокринными клетками;
-гормоны обладают высокой биологической активностью - физиологическое действие проявляется при концентрации их в крови порядка 10-6 - 10-12 моль/л;
-каждый гормон характеризуется присущей только ему структурой, местом синтеза и функцией; дефицит одного гормона не может быть восполнен другими веществами;
-гормоны, как правило, влияют на отдалённые от места их синтеза органы и ткани.
Гормоны осуществляют своё биологическое действие, образуя комплекс со специфическими молекулами – рецепторами. Клетки, содержащие рецепторы к определённому гормону, называются клетками-мишенями для этого гормона. Большинство гормонов взаимодействуют с рецепторами, расположенными на плазматической мембране клеток-мишеней; другие гормоны взаимодействуют с рецепторами, локализованными в цитоплазме и ядре клеток-мишеней. Имейте в виду, что дефицит как гормонов, так и их рецепторов может приводить к развитию заболеваний.
Некоторые гормоны могут синтезироваться эндокринными клетками в виде неактивных предшественников – прогормонов. Прогормоны могут запасаться в большом количестве в специальных секреторных гранулах и быстро активироваться в ответ на соответствующий сигнал.
